题目内容
9.下列离子方程式正确的是( )| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | Al2(SO4)3溶液滴加过量NaOH溶液:Al3++3OH-=Al(OH)3↓ |
分析 A.电子、电荷不守恒;
B.反应生成氢氧化铝和氯化铵;
C.反应生成偏铝酸钠和氢气;
D.反应生成偏铝酸钠.
解答 解:A.钠与水反应的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.AlCl3溶液中加入过量稀氨水的离子反应为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.Al片溶于NaOH溶液中,产生气体的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故C正确;
D.Al2(SO4)3溶液滴加过量NaOH溶液的离子反应为Al3++4OH-=AlO2-+2H2O,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列各组反应,最终一定能得到白色沉淀的是( )
| A. | 向CaCl2溶液中通入SO2气体 | B. | 向Ba(OH)2溶液中通入过量CO2气体 | ||
| C. | 向FeCl2溶液中加入过量NaOH溶液 | D. | 向Al2(SO4)3溶液中加入过量NH3•H2O |
4.下列关于Na2CO3和NaHCO3性质的叙述中,不正确的是( )
| A. | 加入澄清石灰水都有白色沉淀生成 | |
| B. | 向NaOH溶液中通入过量的CO2可制得NaHCO3 | |
| C. | 向饱和Na2CO3溶液中通入足量的CO2没有明显现象 | |
| D. | 可利用稀盐酸来区别Na2CO3、NaHCO3两种无色溶液 |
14.下列溶液中,Cl-的物质的量浓度最大的是( )
| A. | 100mL 0.5mol•L-1AlCl3(aq) | B. | 200mL 0.5mol•L-1MgCl2(aq) | ||
| C. | 300mL 1mol•L-1NaCl(aq) | D. | 400mL 0.5mol•L-1BaCl2(aq) |
1.现有a、b、c三个容器,a容器恒容恒温,b容器恒压恒温,c容器恒容绝热.在三个容器中各充入1mol I2(g)和2mol H2发生反应I2(g)+H2(g)?2HI(g)△H<0,初始时三个容器的体积和温度均相等,则反应达到平衡后,三个容器中I2(g)的转化率的大小关系是( )
| A. | a=b>c | B. | b>a>c | C. | c>b>a | D. | a=b<c |
18.下列实验事实不能用平衡移动原理解释的是( )
| A. |  将NO2球浸泡在冷水中和热水中 | |||||||||||||
| B. | 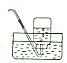 排饱和食盐水收集氯气 | |||||||||||||
| C. | 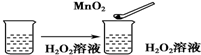 | |||||||||||||
| D. |
| |||||||||||||
19.下列说法中不正确的是( )
| A. | 酯在碱性条件下的水解反应也称为皂化反应 | |
| B. | 植物油通过氢化(加氢)可以变为脂肪 | |
| C. | 天然蛋白质在一定条件下水解的最终产物是α-氨基酸 | |
| D. | 淀粉、纤维素和油脂在一定条件下都能发生水解反应 |
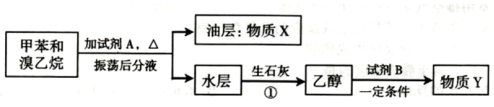
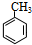 .
.