题目内容
2.甲苯和溴乙烷混合物可通过如图流程进行分离.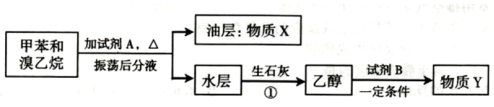
请填写下列空白:
①X的结构简式为
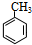 .
.②操作①是否为分液操作否(填“是“或“否”).理由是乙醇易溶于水.
③写出甲苯与溴乙烷的混合物中加入试剂A时发生反应的化学方程式C2H5Br+NaOH$→_{△}^{水}$C2H5OH+NaBr.
④如果Y为乙烯,则试剂B为浓硫酸,“一定条件”是指170℃.
分析 甲苯和溴乙烷中加入试剂A并加热然后分液得到油层、水层,水层中得到乙醇,溴乙烷和氢氧化钠的水溶液、加热得到乙醇,所以试剂A为NaOH的水溶液,甲苯不溶于水,则物质X为 ,水层中含有NaBr、乙醇和水,加入生石灰然后蒸馏得到乙醇,乙醇和试剂B在一定条件下发生反应生成Y,如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,再结合题目解答.
,水层中含有NaBr、乙醇和水,加入生石灰然后蒸馏得到乙醇,乙醇和试剂B在一定条件下发生反应生成Y,如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,再结合题目解答.
解答 解:甲苯和溴乙烷中加入试剂A并加热然后分液得到油层、水层,水层中得到乙醇,溴乙烷和氢氧化钠的水溶液、加热得到乙醇,所以试剂A为NaOH的水溶液,甲苯不溶于水,则物质X为 ,水层中含有NaBr、乙醇和水,加入生石灰然后蒸馏得到乙醇,乙醇和试剂B在一定条件下发生反应生成Y,如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,
,水层中含有NaBr、乙醇和水,加入生石灰然后蒸馏得到乙醇,乙醇和试剂B在一定条件下发生反应生成Y,如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,
(1)通过以上分析知,X结构简式为: ,
,
故答案为: ;
;
(2)乙醇和水互溶,所以不能采用分液方法分离,二者熔沸点不同,所以可以采用蒸馏方法分离,
故答案为:否;乙醇易溶于水;
(3)甲苯和氢氧化钠溶液不反应,溴乙烷和NaOH水溶液在加热条件下发生取代反应生成乙醇,反应方程式为:C2H5Br+NaOH$→_{△}^{水}$C2H5OH+NaBr,
故答案为:C2H5Br+NaOH$→_{△}^{水}$C2H5OH+NaBr;
(4)如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,所以B为浓硫酸、反应条件是170℃,
故答案为:浓硫酸;170℃.
点评 本题考查物质分离与提纯方法的综合应用,题目难度中等,明确实验目的、实验原理为解答关键,可根据物质的性质采用合适的分离和提纯方法,注意熟练掌握常见物质的分离和提纯方法,试题培养了学生的分析、理解能力及化学实验能力.

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-3 mol•L-1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
| c(CO)/×10-3 mol•L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A. | 2s内的平均反应速率υ(CO2)=3.75×10-4mol•L-1•s-1 | |
| B. | 使用催化剂可以提高单位时间内CO和NO的处理量 | |
| C. | 若将容积缩小为原来的一半,CO平衡转化率大于25% | |
| D. | 若温度降低,该反应的平衡常数增大,则该反应的△H>0 |
| A. | NaCl | B. | Al | C. | C2H5OH | D. | NaOH溶液 |
| A. | 26.33 2mol | B. | 30.5 2mol | C. | 26.33 1mol | D. | 30.5 1mol |
| A. | 电泳现象可证明胶体带电荷 | |
| B. | 直径在1~100mm之间的粒子称为胶体 | |
| C. | 是否具有丁达尔效应是溶液和胶体的本质区别 | |
| D. | 胶体粒子很小,可以透过滤纸 |
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | Al2(SO4)3溶液滴加过量NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| A. | 蒸发AlCl3溶液获得AlCl3固体 | |
| B. | 将Fe2(SO4)3溶液与NaOH溶液混合制备Fe(OH)3胶体 | |
| C. | 测定Na2CO3溶液、Na2SO3溶液的pH,比较C、S的非金属性强弱 | |
| D. | 以粗铜作阳极,纯铜片作阴极,CuCl2溶液作电解质溶液,电解精炼铜 |
 验证NH4Cl晶体中含有NH4+.将少量晶体于两端开口的硬质玻璃管中加热,如图所示.
验证NH4Cl晶体中含有NH4+.将少量晶体于两端开口的硬质玻璃管中加热,如图所示.


