题目内容
1.现有a、b、c三个容器,a容器恒容恒温,b容器恒压恒温,c容器恒容绝热.在三个容器中各充入1mol I2(g)和2mol H2发生反应I2(g)+H2(g)?2HI(g)△H<0,初始时三个容器的体积和温度均相等,则反应达到平衡后,三个容器中I2(g)的转化率的大小关系是( )| A. | a=b>c | B. | b>a>c | C. | c>b>a | D. | a=b<c |
分析 对于I2(g)+H2(g)?2HI(g)△H<0,反应前后气体的体积不变,则增大压强平衡不移动,正反应为放热反应,升高温度平衡逆向移动,c容器恒容绝热,则温度高于a、b,以此解答该题.
解答 解:对于I2(g)+H2(g)?2HI(g)△H<0,反应前后气体的体积不变,则增大压强平衡不移动,a容器恒容恒温,b容器恒压恒温,由于压强对平衡无影响,则I2(g)的转化率的大小关系是a=b,正反应为放热反应,升高温度平衡逆向移动,c容器恒容绝热,则温度高于a、b,则a=b>c.
故选A.
点评 本题考查了化学平衡影响因素,侧重考查容器特征、化学平衡移动原理,为高频考点,注意恒温恒容容器、恒温恒压容器、恒容绝热容器改变条件对平衡的分析方法,题目难度中等.

练习册系列答案
相关题目
13.下列物质中,属于电解质的是( )
| A. | NaCl | B. | Al | C. | C2H5OH | D. | NaOH溶液 |
12.下列有关叙述正确的是( )
| A. | 电泳现象可证明胶体带电荷 | |
| B. | 直径在1~100mm之间的粒子称为胶体 | |
| C. | 是否具有丁达尔效应是溶液和胶体的本质区别 | |
| D. | 胶体粒子很小,可以透过滤纸 |
9.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | Al2(SO4)3溶液滴加过量NaOH溶液:Al3++3OH-=Al(OH)3↓ |
16.如图是电解熔融 NaCl 制备金属钠的装置示意图,下列有关判断正确的是( )
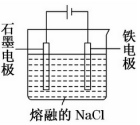

| A. | 通过该装置可以将化学能转化为电能 | |
| B. | 石墨电极为正极 | |
| C. | Na+在铁电极上得到电子被还原为钠 | |
| D. | 电流从负极流出,流入铁电极 |
6.1669年德围炼金术士H•布兰德将砂子、木炭、生石灰、尿液混合,加热蒸馏,得到一种类似白蜡的物质,在空气中发出冷光.已知该物质所的组成元素与氮同主族,则有关该元素的说法正确的是( )
| A. | 该元素最高价氧化物对应水化物的酸强于硝酸 | |
| B. | 该元素最高价含氧酸的钠盐(正盐)能够促进水的电离 | |
| C. | 该元素形成的氢化物的沸点高于氨气 | |
| D. | 该元素在地壳中的含量大于硅元素 |
13.已知X、Y、Z、W(含同一元素)有如图所示的转化关系,若X是一种单质,W为一种含氧酸,则X不可能是( )

| A. | Na | B. | S | C. | C | D. | Si |
10.下列实验操作能达到预期目的是( )
| A. | 蒸发AlCl3溶液获得AlCl3固体 | |
| B. | 将Fe2(SO4)3溶液与NaOH溶液混合制备Fe(OH)3胶体 | |
| C. | 测定Na2CO3溶液、Na2SO3溶液的pH,比较C、S的非金属性强弱 | |
| D. | 以粗铜作阳极,纯铜片作阴极,CuCl2溶液作电解质溶液,电解精炼铜 |
11. 华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
 华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )| A. | 分子中2个苯环一定处于同一平面 | |
| B. | 1mol华法林最多能与2mol NaOH反应 | |
| C. | 在一定条件下,华法林可与HCHO发生缩聚反应 | |
| D. | 在NaOH水溶液中加热,华法林可发生消去反应 |