题目内容
6.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )| A. | 标准状况下,22.4 LH2O中含有极性键的数目为2NA | |
| B. | 78 g Na2O2中含有的阴离子数为NA | |
| C. | 11 g重水(D218O)中含有的电子数力5NA | |
| D. | 常温常压下,5.6 g铁粉在7.1 g氯气中充分燃烧,转移的电子数为0.2NA |
分析 A、标况下水为液体;
B、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;
C、求出重水的物质的量,然后根据重水中含10个电子来分析;
D、5.6g铁的物质的量为0.1mol,7.1g氯气的物质的量为0.1mol,而0.1mol铁在0.1mol氯气中燃烧时氯气不足.
解答 解:A、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量和极性键的个数,故A错误;
B、78g过氧化钠的物质的量为1mol,而过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含NA个阴离子,故B正确;
C、11g重水的物质的量n=$\frac{11g}{22g/mol}$=0.5mol,而重水中含10个电子,故0.5mol重水中含5mol电子即5NA个,故C正确;
D、5.6g铁的物质的量为0.1mol,7.1g氯气的物质的量为0.1mol,而0.1mol铁在0.1mol氯气中燃烧时氯气不足,而氯气反应后变为-1价,故0.1mol氯气转移0.2NA个电子,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
17.有一种有机化合物,其结构简式如图,下列有关它的性质的叙述,正确的是( )

| A. | 有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2 | |
| B. | 在一定条件下,1mol该物质最多能与7mol NaOH完全反应 | |
| C. | 在Ni催化下,1mol该物质可以和8mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
14.某有机物的结构简式为 ,下列说法正确的是( )
,下列说法正确的是( )
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该物质的分子式为C11H10O3 | |
| B. | 该有机物含有4种官能团 | |
| C. | 1 mol该有机物最多可以消耗2 mol NaOH | |
| D. | 该有机物不能发生消去反应 |
11. 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
 为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示.下列说法正确的是( )| A. | 电子从b极经导线流向a极 | |
| B. | 正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 还可以选用NaOH固体作固态电解质 | |
| D. | 若反应中转移1 mol电子,则生成22.4L(标准状况)CO2 |
18.下列关于元素周期表的描述正确的是( )
| A. | 有7个周期,18个族 | |
| B. | 第IA族元素也称为碱金属元素 | |
| C. | 元素种类最多的族为第IIIB族 | |
| D. | 第七周期若排满,最多可排50种元素 |
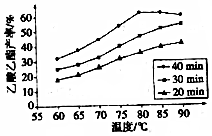 有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题:
有机酸种类繁多,广泛分布于中草葯的叶、根、特别是果实中,是有机合成、工农业生产的重要原料,请回答下列有关问题: .
.