题目内容
1.常温下,下列关于溶液的说法不正确的是( )①加水稀释FeCl3溶液,$\frac{c(F{e}^{3+})}{c(C{l}^{-})}$的值减小
②浓度均为0.1mol•L-l的Na2CO3和NaHCO3的混合溶液中:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③向0.1mol•L-1的氨水中滴加等浓度的盐酸,恰好中和时溶液的pH=a,则溶液中由水电离产生的c(OH-)=10-amol•L-1
④pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合.反应后所得溶液中:c(CH3COOH)>c(CH3COO-)>c(Na+)
⑤Na2S 稀溶液中:c(OH-)=c(H+)+c( H2S)+c( HS-)
| A. | ②⑤ | B. | ①②⑤ | C. | ②③④⑤ | D. | ①②④ |
分析 ①加水稀释FeCl3溶液,促进电离,所以铁的物质的量减小,而氯离子的物质的量不变;
②体积未知,不能确定体积之间的关系;
③完全中和生成氯化铵,为强酸弱碱盐,水解呈酸性;
④pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合,得到醋酸和醋酸钠的混合溶液,以醋酸的电离为主溶液呈酸性;
⑤Na2S 稀溶液中根据质子守恒可知c(OH-)=c(H+)+2c( H2S)+c( HS-).
解答 解:①加水稀释FeCl3溶液,促进电离,所以铁的物质的量减小,而氯离子的物质的量不变,所以$\frac{n(F{e}^{3+})}{n(C{l}^{-})}$变小,即$\frac{c(F{e}^{3+})}{c(C{l}^{-})}$的值减小,故正确;
②浓度均为0.1mol•L-1的Na2CO3、NaHCO3混合溶液,因体积不能确定,而不能确定离子浓度之间的关系,故错误;
③在0.1mol•L-1氨水中滴加0.1mol•L-1盐酸,刚好完全中和时pH=a,则溶液中c(OH-)=c(H+)=10-amol•L-1,故正确;
④pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合,得到醋酸和醋酸钠的混合溶液,以醋酸的电离为主溶液呈酸性,所以离子的浓度大小为:c(CH3COOH)>c(CH3COO-)>c(Na+),故正确;
⑤Na2S 稀溶液中根据质子守恒可知c(OH-)=c(H+)+2c( H2S)+c( HS-),故错误;
故选A.
点评 本题考查了溶液pH的计算、溶液中离子浓度大小比较、难溶电解质的沉淀平衡等知识,题目难度中等,注意掌握酸碱混合后溶液的定性判断及溶液中pH的计算方法,学会利用电荷守恒、物料守恒、盐的水解原理结合溶液中的电离平衡问题.

练习册系列答案
相关题目
9.乙酸乙酯和丁酸互为同分异构体,下列方法中不能对二者进行鉴别的是( )
| A. | 利用金属钠 | B. | 利用质谱法 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
16.下列说法中,正确的是( )
| A. | 在离子化合物中不可能含有共价键 | |
| B. | 在共价化合物中也可能含有离子键 | |
| C. | 凡含有离子键的化合物一定是离子化合物 | |
| D. | 完全由非金属元素组成的化合物一定是离子化合物 |
6.设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 标准状况下,22.4 LH2O中含有极性键的数目为2NA | |
| B. | 78 g Na2O2中含有的阴离子数为NA | |
| C. | 11 g重水(D218O)中含有的电子数力5NA | |
| D. | 常温常压下,5.6 g铁粉在7.1 g氯气中充分燃烧,转移的电子数为0.2NA |
11.下列说法中正确的是( )
| A. | 绿色植物的光合作用是把热能转化为化学能的过程 | |
| B. | 生物能是与化学反应无关的一种能源 | |
| C. | 化学能只能以热能的形式释放 | |
| D. | 葡萄糖在人体内的氧化是放热反应 |
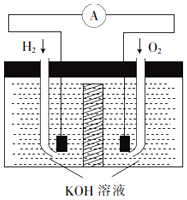 氢氧燃料电池是符合绿色化学理念的新型发电装置.其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定.
氢氧燃料电池是符合绿色化学理念的新型发电装置.其工作原理如图所示,该电池的电极表面镀了一层细小的铂粉,已知铂吸附气体的能力强,且性质稳定.