题目内容
20.根据下列转化关系,回答有关问题.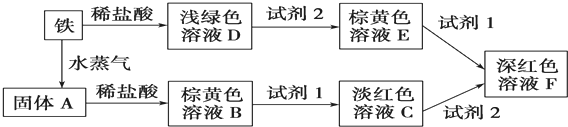
(1)浅绿色溶液D主要成分的化学式为FeCl2,试剂1是KSCN溶液.
(2)下列物质不能作为试剂2的是d(填序号).
a.Cl2 b.新制氯水 c.浓硫酸 d.S e.硝酸
(3)固体A溶于稀盐酸的化学方程式Fe3O4+8H+═Fe2++2Fe3++4H2O.
(4)溶液C到溶液F红色加深的原因是溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+浓度增大,从而生成更多的硫氰化铁使红色加深.
分析 (1)Fe与HCl反应生成氯化亚铁溶液;检验铁离子用KSCN溶液;
(2)亚铁离子被氧化剂氧化为铁离子;
(3)Fe在高温下与水蒸气反应生成四氧化三铁,四氧化三铁与盐酸反应生成氯化亚铁和氯化铁;
(4)Fe2+被氧化剂氧化成Fe3+,Fe3+浓度增大.
解答 解:(1)Fe与HCl反应生成氯化亚铁溶液,亚铁离子的溶液显浅绿色,则浅绿色溶液D主要成分的化学式为FeCl2;三价铁离子的溶液显棕黄色,检验铁离子用KSCN溶液;
故答案为:FeCl2;KSCN溶液;
(2)浅绿色溶液D转化为棕黄色溶液,是亚铁离子被氧化剂氧化为铁离子,选择氧化性大于铁离子的物质,所以可以选氯气、氯水、浓硫酸、硝酸等强氧化性物质,S的氧化性较弱不能氧化亚铁离子;
故答案为:d;
(3)Fe在高温下与水蒸气反应生成四氧化三铁,四氧化三铁与盐酸反应生成氯化亚铁和氯化铁,则四氧化三铁与盐酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O,
故答案为:Fe3O4+8H+═Fe2++2Fe3++4H2O;
(4)C溶液中含有亚铁离子和铁离子,向该溶液中加氧化剂,Fe2+被氧化剂氧化成Fe3+,Fe3+浓度增大,从而生成更多的硫氰化铁使红色加深;
故答案为:溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+浓度增大,从而生成更多的硫氰化铁使红色加深.
点评 本题考查了元素化合物性质与转化、离子检验,熟练掌握元素化合物的性质以及铁离子的检验方法是解题关键,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.在25℃、101kPa下,0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,下列热化学方程式正确的是( )
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1451.6 kJ/mol | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.8 kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6 kJ/mol |
8.短周期主族元素X、Y、Z、W的原子序数依次递增,X的一种原子核内无中子,Y原子最外层电子数是内层电子总数的2倍,W原子最外层电子数是Y原子最外层电子数的1.5倍,Z、W同主族,下列说法正确的是( )
| A. | X与Y形成原子个数比1:1的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
15.如图为元素周期表中短周期主族元素的一部分.下列关于这四种元素及其化合物的说法中正确的是( )
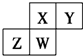

| A. | 原子半径:W>Z>Y>X | |
| B. | W的最高正价与最低负价的绝对值可能相等 | |
| C. | 气态氢化物的稳定性:Z>W>X>Y | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
12.X、Y两种元素均为短周期元素,X元素的原子所具有的电子层数为其最外层电子数的二分之一.下列有关判断中,正确的是( )
| A. | X元素在周期表中的位置只能是第二周期第ⅣA族 | |
| B. | 若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强 | |
| C. | 若Y的非金属性比X的强,则与同一种还原剂反应时,一个Y原子得到的电子数一定比一个X原子得到的电子数少 | |
| D. | 若X能形成XO32-、XO42-和X2O32-,Y能形成YO3-和XO4-,则X、Y一定在同一周期 |
 .
.