题目内容
9.实验室制取氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,氯气溶于水发生反应的离子方程式为Cl2+H2O=HClO+H++Cl-,用硝酸银溶液可以检验所得的氯水中含有Cl-.分析 实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水,氯气溶于水和水发生反应生成盐酸和次氯酸,检验溶液中氯离子可以利用硝酸银溶液中的银离子结合氯离子生成氯化银沉淀检验存在.
解答 解:实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,氯气溶于水和水发生反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O=HClO+H++Cl-,检验溶液中氯离子可以利用硝酸银溶液中的银离子结合氯离子生成氯化银沉淀检验存在,Ag++Cl-=AgCl↓,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;Cl2+H2O=HClO+H++Cl-;硝酸银溶液.
点评 本题考查了氨气实验室制备,氯气性质和离子检验,注意基础知识的积累,题目较简单.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
4.常温下,下列溶液可以用铁罐车装运的是( )
| A. | 氢氧化钠溶液 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 稀硝酸 |
14.下列说法正确的是( )
| A. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| C. | SO2、SiO2、CO均为酸性氧化物 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
19.25℃时,将某强酸和某强碱溶液按10:1的体积比混合溶液恰好呈中性,则混合前此强酸与强碱溶液的pH之和是( )
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
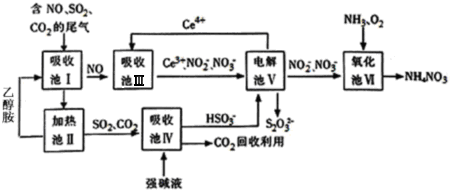
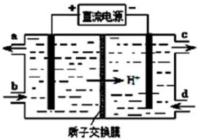
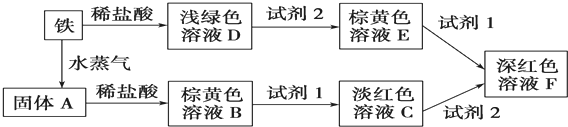
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.