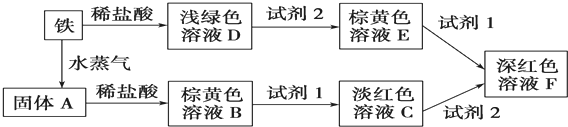
题目内容
11.在25℃、101kPa下,0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,下列热化学方程式正确的是( )| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1451.6 kJ/mol | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.8 kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1451.6 kJ/mol |
分析 0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.8kJ,64g甲醇即2mol甲醇燃烧放的热量为1451.6kJ,根据热化学方程式的书写方法来回答.
解答 解:A、0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.8kJ,热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);△H=-725.8 kJ•mol-1,故A正确;
B、2CH3OH(l)+3O2(g)=2 CO2(g)+4H2O(l)△H=-1451.6 kJ•mol-1,水是液态,故B错误;
C、反应吸热时焓变值为正值,放热时焓变值为负值,甲醇燃烧是放热反应,故△H<0,故C错误;
D、0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,则64g甲醇即2mol甲醇燃烧放的热量为1451.6kJ,根据热化学方程式的书写方法写出为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),水是液态,△H=-1451.6kJ/mol,故D正确;
故选AD.
点评 本题主要考查学生热化学方程式的书写方法及系数的含义,注意焓变的正负和单位问题,该题型是考试的热点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法正确的是( )
| A. | 过渡元素均为金属元素 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 含离子键的晶体一定是离子晶体,含共价键的晶体一定是分子晶体 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
2.将一小块钠投入下列溶液中,既能产生气体又会出现沉淀的是( )
| A. | 稀H2SO4 | B. | 氢氧化钠溶液 | C. | NH4Cl溶液 | D. | 氯化镁溶液 |
16.下列电离方程式书写正确的是( )
| A. | H2CO3═2H++CO32- | B. | NaClO═Na++Cl-+O2- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NaOH═Na++OH- |
3.碱式氯化镁(MgOHCl)常用于塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创.某科研小组同学根据该原理设计了如图实验装置来制备碱式氯化镁并探究氨的催化氧化反应,其中CuO的质量为8.0g.
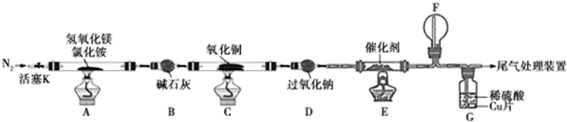
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
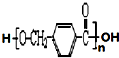
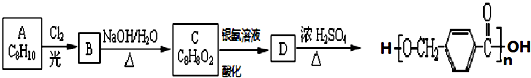
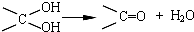
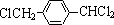 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.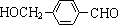 +2Ag(NH3)2OH $\stackrel{△}{→}$
+2Ag(NH3)2OH $\stackrel{△}{→}$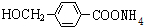 +2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n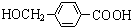 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$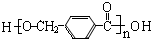 +(n-1)H2O
+(n-1)H2O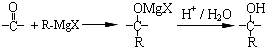
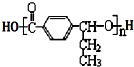 在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)