题目内容
12.X、Y两种元素均为短周期元素,X元素的原子所具有的电子层数为其最外层电子数的二分之一.下列有关判断中,正确的是( )| A. | X元素在周期表中的位置只能是第二周期第ⅣA族 | |
| B. | 若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强 | |
| C. | 若Y的非金属性比X的强,则与同一种还原剂反应时,一个Y原子得到的电子数一定比一个X原子得到的电子数少 | |
| D. | 若X能形成XO32-、XO42-和X2O32-,Y能形成YO3-和XO4-,则X、Y一定在同一周期 |
分析 A.X、Y两种元素均为短周期元素,X元素的原子所具有的电子层数为其最外层电子数的二分之一,则X可能是He、C、S元素;
B.若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强;
C.非金属性强弱与得电子难易程度有关,与得电子多少无关;
D.若X能形成XO32-、XO42-和X2O32-,Y能形成YO3-和XO4-,则X是S元素、Y是Cl元素.
解答 解:A.元素在周期表中的位置可能是第二周期第ⅣA族,也可能是第三周期第ⅥA族,如为第3周期元素,则X为S,故A错误;
B.元素的非金属性越强,对应的单质的氧化性越强,若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应置换出X,则说明Y的非金属性比X的强,故B正确;
C.元素的非金属性与得电子难易有关,与得电子多少无关,如二者不在同一周期,则一个Y原子得到的电子数不一定比一个X原子得到的电子数少,如:N原子得电子比S原子多,O原子与S原子同,故C错误;
D.若X能形成XO32-、XO42-和X2O32-,则X为S元素,Y能形成YO3-和YO4-,Y为Cl元素,二者在同一周期,故D正确.
故选:BD.
点评 本题考查位置结构性质的相互关系应用,题目难度中等,侧重考查原子的核外电子排布特点,同时考查学生发散思维能力,熟练掌握原子结构、元素周期表结构.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
2.将一小块钠投入下列溶液中,既能产生气体又会出现沉淀的是( )
| A. | 稀H2SO4 | B. | 氢氧化钠溶液 | C. | NH4Cl溶液 | D. | 氯化镁溶液 |
3.碱式氯化镁(MgOHCl)常用于塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创.某科研小组同学根据该原理设计了如图实验装置来制备碱式氯化镁并探究氨的催化氧化反应,其中CuO的质量为8.0g.
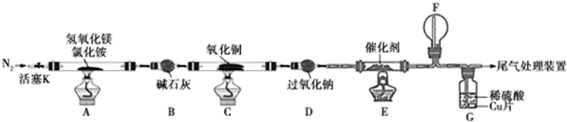
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
7.某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4mol•L-1,c(Y2)=0.6mol•L-1,c(Z)=0.4mol•L-1,则该反应的化学方程式可表示为( )
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y2?XY2 | D. | 2X2+Y2?2X2Y |
4.常温下,下列溶液可以用铁罐车装运的是( )
| A. | 氢氧化钠溶液 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 稀硝酸 |
2.下列离子方程式中,正确的是( )
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| B. | 溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量的CO2通入稀的碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-反应完全2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.