题目内容
5.某课外学习小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去):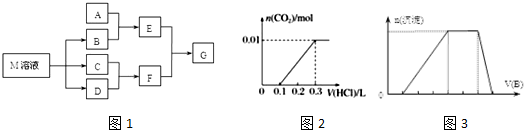
(1)写出F的电子式
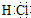 .
.(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是水玻璃
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,如图2所示,则A与B溶液反应后溶液中的溶质化学式为NaHCO3、Na2CO3.
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是液中逐渐有白色絮状沉淀生成,且不断地增加,随后沉淀逐渐溶解最终消失.
(5)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(6)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知,该溶液中肯定含有的离子及其浓度之比为c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3.
分析 (1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,E与F溶液反应可以制备G为H2SiO3;
(3)曲线中,从0.1L~0.3L发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,该阶段消耗盐酸为200mL,而开始产生二氧化碳时消耗盐酸为100mL,小于200mL,所以溶液中的溶质成分NaHCO3、Na2CO3;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解;
(5)若A是一种化肥,实验室可用A和NaOH反应制取气体E,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则氨气与氯气反应生成氯化铵,同时生成氮气;
(6)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,根据各阶段消耗的NaOH体积结合离子方程式计算n(H+):n(Al3+):n(NH4+)之比,再结合电荷守恒计算与n(SO42-)的比例关系,据此计算.
解答 解:(1)C可在D中燃烧发出苍白色火焰,为氢气与氯气反应生成HCl,可推知C为H2、D为Cl2、F为HCl,M是日常生活中不可缺少的调味品,由转化关系可知,M的溶液电解生成氢气、氯气与B,可推知M为NaCl、B为NaOH,HCl的电子式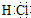 ,故答案为:
,故答案为: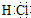 ;
;
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,则A为SiO2,E为Na2SiO3,与F溶液反应可以制备G为H2SiO3,E溶液的俗称是水玻璃.故答案为:水玻璃;
(3)曲线中,从0.1L~0.3L发生反应NaHCO3+HCl=NaCl+CO2↑+H2O,该阶段消耗盐酸为200mL,而开始产生二氧化碳时消耗盐酸为100mL,小于200mL,所以溶液中的溶质成分NaHCO3、Na2CO3,故答案为:NaHCO3、Na2CO3;
(4)若A是一种常见金属单质,且与NaOH溶液能够反应,则A为Al,E为NaAlO2,则将过量的HCl溶液逐滴加入NaAlO2溶液中,先生成氢氧化铝,而后氢氧化铝溶解,故看到的现象为:液中逐渐有白色絮状沉淀生成,且不断地增加,随后沉淀逐渐溶解最终消失,
故答案为:液中逐渐有白色絮状沉淀生成,且不断地增加,随后沉淀逐渐溶解最终消失;
(5)若A是一种化肥,实验室可用A和NaOH反应制取气体E,则E为NH3、A为铵盐,E与氯气相遇均冒白烟,且利用E与氯气的反应检验输送氯气的管道是否泄露,则氨气与氯气反应生成氯化铵,同时生成氮气,反应方程式为:3Cl2+8NH3=N2+6NH4Cl,故答案为:3Cl2+8NH3=N2+6NH4Cl;
(6)由图可知,开始加入NaOH没有沉淀和气体产生,则一定有H+,一定没有CO32-,后来有沉淀产生且最后消失,则一定没有Mg2+、Fe3+,一定含有Al3+;中间段沉淀的质量不变,应为NH4++OH-=NH3•H2O的反应,则含有NH4+,由电荷守恒可知一定含有SO42-,发生反应H++OH-=H2O,氢离子消耗NaOH溶液的体积为1体积,发生反应Al3++3OH-=Al(OH)3↓,铝离子消耗NaOH溶液的体积为3体积,发生反应NH4++OH-=NH3•H2O,铵根消耗氢氧化钠为2体积,则n(H+):n(Al3+):n(NH4+)=1:1:2,由电荷守恒可知,n(H+):n(Al3+):n(NH4+):n(SO42-)=1:1:2:3,故c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3,
故答案为:c(H+):c(Al3+):c(NH4+):c(SO42-)=1:1:2:3.
点评 本题考查无机物推断等,题目涉及元素化合物较多,需要学生全面掌握据基础知识,(6)中根据图象中的平台确定含有铵根离子是关键,注意离子方程式与电荷守恒的应用,难度中等.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案| A. | 将钠投入FeSO4溶液中,可以得到单质铁 | |
| B. | 将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色 | |
| C. | Na2O与Na2O2中阴阳离子的个数比均为1:2 | |
| D. | 在2Na2O2+2H2O=4NaOH+O2反应中,每生成1molO2,消耗2mol氧化剂 |
| A. | H2CO3═2H++CO32- | B. | NaClO═Na++Cl-+O2- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NaOH═Na++OH- |
| A. | 酸性:H2SO4>H3PO4 | B. | 碱性:KOH>NaOH | ||
| C. | 原子半径:S<Cl | D. | 稳定性:NH3>CH4 |
| A. | 合成纤维、人造纤维及碳纤维都属于有机高分子材料 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| C. | SO2、SiO2、CO均为酸性氧化物 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
 硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.
硝酸是一种重要的工业原料,工业制硝酸的关键是氨的催化氧化,与硝酸工业相关的过程中产生的氮氧化物的处理与应用也是科学研究的热点.