题目内容
15.如图为元素周期表中短周期主族元素的一部分.下列关于这四种元素及其化合物的说法中正确的是( )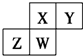
| A. | 原子半径:W>Z>Y>X | |
| B. | W的最高正价与最低负价的绝对值可能相等 | |
| C. | 气态氢化物的稳定性:Z>W>X>Y | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
分析 A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,据此可判断各原子半径大小;
B.W有可能为C元素,其最高正价与最低负价的绝对值都是4;
C.非金属性强弱为Y>X>W>Z,非金属性越强,对于气态氢化物越稳定;
D.Z可能为Al,氢氧化铝不是强碱.
解答 解:同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱.同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强,
A.电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子半径大小为:Z>W>X>Y,故A错误;
B.W有可能位于第ⅣA,如C元素,最高正价与最低负价的绝对值都是4,故B正确;
C.非金属性强弱为Y>X>W>Z,所以氢化物的稳定性也是Y>X>W>Z,故C错误;
D.根据位置可判断,Z的最小原子序数是13,氢氧化铝是两性氢氧化物,而不是强碱,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确原子结构与元素周期律、元素周期律的关系为解答关键,注意掌握元素周期律的内容,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
5.下列说法不正确的是( )
| A. | 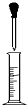 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 | |
| B. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| C. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| D. | 热化学方程式中,如果没有注明温度和压强,表示反应热是在25℃,101KPa测得的 |
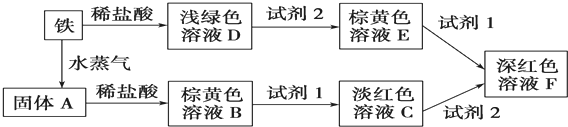
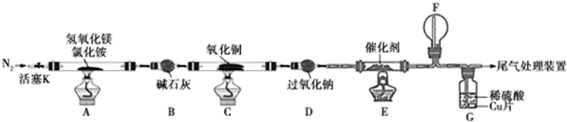
3.碱式氯化镁(MgOHCl)常用于塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创.某科研小组同学根据该原理设计了如图实验装置来制备碱式氯化镁并探究氨的催化氧化反应,其中CuO的质量为8.0g.
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液

请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为Mg(OH)2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$MgOHCl+NH3↑+H2O.
(2)反应过程中持续通入N2的作用有两点:一是使装置A中产生的氨气完全导出,二是防止倒吸.
(3)一段时间后,你认为装置F中可观察到什么现象?生成红棕色气体.
(4)用离子方程式解释装置G中溶液变成蓝色的原因:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
(5)反应完毕,装置C中的氧化铜完全反应,由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,则红色固体是Cu和Cu2O,该反应中电子转移的物质的量为0.15mol.
(6)请你设计一个实验方案,证明装置C中完全反应后的红色固体中含氧化亚铜.
已知:①Cu2O+H+=Cu2++Cu ②限选试剂:2mol/LH2SO4溶液、12mol/LH2SO4溶液、2mol/LHNO3溶液、10mol/LHNO3溶液
| 实验步骤 | 预期现象和结论 |
| 步骤1:取装置C中反应后的少许固体于试管中 | \ |
| 步骤2:向试管中加入2mol/LH2SO4溶液 | 液中出现蓝色,说明红色固体中含有Cu2O |
10.下列说法正确的是( )
| A. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 由BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H1=+571.2kJ•mol-1①BaSO4(s)+2C(s)═2CO2(g)+BaS(s)△H2=+226.2kJ•mol-1②可得反应C(s)+CO2(g)═2CO(g) 的△H=+172.5kJ•mol-1 |
7.某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4mol•L-1,c(Y2)=0.6mol•L-1,c(Z)=0.4mol•L-1,则该反应的化学方程式可表示为( )
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y2?XY2 | D. | 2X2+Y2?2X2Y |
4.常温下,下列溶液可以用铁罐车装运的是( )
| A. | 氢氧化钠溶液 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 稀硝酸 |
5.化学与生产、生活密切相关,下列叙述错误的是( )
| A. | 饱和Na2SO4溶液可以使蛋白质变性 | |
| B. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| C. | 从海带中提取碘单质的过程涉及氧化还原反应 | |
| D. | 镀锌铁桶镀层破损后铁仍不易被腐蚀 |
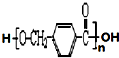
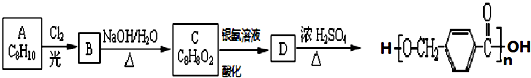
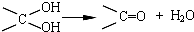
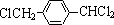 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.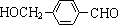 +2Ag(NH3)2OH $\stackrel{△}{→}$
+2Ag(NH3)2OH $\stackrel{△}{→}$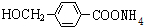 +2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O,由D生成高分子化合物的反应n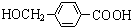 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$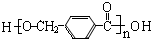 +(n-1)H2O
+(n-1)H2O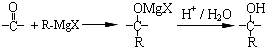
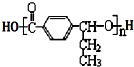 在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)