题目内容
17.下列实验中,现象和对应结论均正确的是( )| 选项 | 实验 | 现象 | 结论 |
| A | T℃时,向NaCl和NaBr的混合 溶液中滴加AgNO3溶液 | 先出现白色沉淀 | T℃时,Ksp: AgCl<AgBr |
| B | 向等浓度的Na2CO3溶液或Na2SO4 溶液中滴加酚酞试剂 | Na2CO3溶液变红色,Na2SO4 溶液无明显现象 | 非金属性:S>C |
| C | 常温下,取饱和CaSO4溶液或醋酸 溶液做导电性实验 | 醋酸实验的灯泡较亮 | CaSO4和醋酸均 为弱电解质 |
| D | 向品红溶液中滴加NaClO溶液 或通入SO2气体 | 品红溶液均褪为无色 | 两者均有漂白性 且原理相同 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶度积常数表达式相同时,溶度积小的物质先沉淀,当浓度商大于溶度积时产生沉淀;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,其对应的钠盐溶液pH越小;
C.电解质强弱是根据电离程度划分的,溶液导电性强弱与离子浓度有关;
D.次氯酸钠溶液具有强氧化性,二氧化硫能和有色物质反应生成无色物质.
解答 解:A.溶度积常数表达式相同时,溶度积小的物质先沉淀,当浓度商大于溶度积时产生沉淀,该实验中先生成白色沉淀,说明c(Cl-).c(Ag+)>Ksp(AgCl),但不能说明Ksp:AgCl<AgBr,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,其对应的钠盐溶液pH越小,向等浓度的Na2CO3溶液或Na2SO4溶液中滴加酚酞试剂,Na2CO3溶液变红色,Na2SO4溶液无明显现象,说明碳酸钠溶液碱性大于硫酸钠,则非金属性S>C,故B正确;
C.电解质强弱是根据电离程度划分的,溶液导电性强弱与离子浓度有关,硫酸钙为微溶物,醋酸易溶于水,醋酸溶液中灯泡亮,说明醋酸中离子浓度大于硫酸钙溶液,但溶解的硫酸钙完全溶解,为强电解质,故C错误;
D.次氯酸钠溶液具有强氧化性,能氧化品红溶液而漂白品红溶液,二氧化硫能和有色物质反应生成无色物质而体现漂白性,二者反应原理不同,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质漂白性、电解质强弱判断、非金属性强弱比较、溶度积大小比较等知识点,明确实验原理、物质性质是解本题关键,注意:电解质强弱与溶液导电性强弱、溶质溶解度大小等因素无关,为易错点.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
5.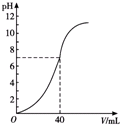 用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
 用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )| A. | 0.5 mol•L-1 100 mL | B. | 0.5 mol•L-180 mL | ||
| C. | 1 mol•L-160 mL | D. | 1 mol•L-180 mL |
2.下列关于NA的说法正确的是( )
| A. | 含H2SO40.2mol的浓硫酸与足量的Cu反应可产生SO2分子数为0.1NA | |
| B. | 足量Fe与1 mol氯气反应,转移的电子数为3NA | |
| C. | 标准状况下,22.4LSO3含有分子的数目为NA个 | |
| D. | 1molNa2O2所含离子总数为3NA |
9.通过α粒子轰击金箔的实验现象,否定葡萄干面包原子模型,提出新的原子结构模型的科学家是( )
| A. | 汤姆孙 | B. | 伦琴 | C. | 道尔顿 | D. | 卢瑟福 |
7.下列说法正确的是( )
| A. | 石蜡油分解产生的气态产物中不含有不饱和烃 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 油脂是种高级脂肪酸甘油酯,其中植物油通过氢化可以变成脂肪 | |
| D. | 苯与浓硝酸、浓硫酸混合,加强热以制备硝基苯 |
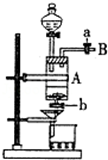 三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.