题目内容
5.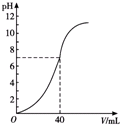 用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )| A. | 0.5 mol•L-1 100 mL | B. | 0.5 mol•L-180 mL | ||
| C. | 1 mol•L-160 mL | D. | 1 mol•L-180 mL |
分析 根据图象可知,起始时硫酸溶液的pH=0,氢离子浓度为1mol/L,则H2SO4的起始浓度为c(H2SO4)=0.5 mol•L-1;当加入40 mL 1mol•L-1 NaOH溶液时,恰好和硫酸能中和,溶液的pH=7,据此计算出消耗硫酸的体积.
解答 解:由图象可知,加入氢氧化钠溶液之前,溶液的pH=0,氢离子浓度为1mol/L,则H2SO4的起始浓度为c(H2SO4)=0.5 mol•L-1;
当加入40 mL 1mol•L-1 NaOH溶液时,恰好和硫酸能中和,溶液的pH=7,根据反应关系式:H2SO4~2NaOH,消耗硫酸溶液的体积V为:2×V×0.5 mol•L-1=1mol/L×0.04L,解得V=0.02L=40mL,反应后溶液的体积为:80mL,
故选B.
点评 本题考查了酸碱混合时的定性判断及有关溶液pH的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,解此题有两个关键点,一是从图象上看,起始时硫酸溶液的pH=0,则H2SO4的起始浓度为0.5 mol•L-1,二是加40 mL NaOH溶液时,恰好和硫酸能中和,pH=7.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
13.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:
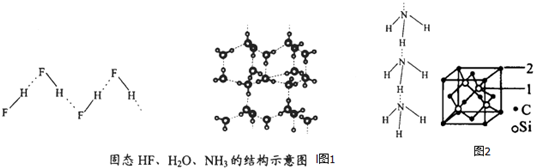
解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如下:
| 物质 | 氢键X-H…Y | 键能kJ•mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
20.下列说法不正确的是( )
| A. | 在汽油中加入乙醇热值改变 | |
| B. | 秸秆燃烧是造成雾霾的原因之一 | |
| C. | 用牺牲阴极的方法可以保护金属 | |
| D. | 自行车钢架生锈主要是电化学腐蚀所致 |
10.下列叙述正确的是( )
| A. | 同一主族的元素,原子半径越大,其单质的熔点一定越高 | |
| B. | 只要含有金属阴离子的晶体就一定是离子晶体 | |
| C. | 第三周期元素的离子半径从左到右逐渐减小 | |
| D. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
17.下列实验中,现象和对应结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | T℃时,向NaCl和NaBr的混合 溶液中滴加AgNO3溶液 | 先出现白色沉淀 | T℃时,Ksp: AgCl<AgBr |
| B | 向等浓度的Na2CO3溶液或Na2SO4 溶液中滴加酚酞试剂 | Na2CO3溶液变红色,Na2SO4 溶液无明显现象 | 非金属性:S>C |
| C | 常温下,取饱和CaSO4溶液或醋酸 溶液做导电性实验 | 醋酸实验的灯泡较亮 | CaSO4和醋酸均 为弱电解质 |
| D | 向品红溶液中滴加NaClO溶液 或通入SO2气体 | 品红溶液均褪为无色 | 两者均有漂白性 且原理相同 |
| A. | A | B. | B | C. | C | D. | D |

 .
. .
. .
. 、CH3CH2OH和
、CH3CH2OH和 为原料,合成
为原料,合成 ,写出合成流程图(无机试剂任用).
,写出合成流程图(无机试剂任用).
 ;E的离子结构示意图
;E的离子结构示意图 .
.