题目内容
17.下列有关实验原理或操作不正确的是( )| A. | 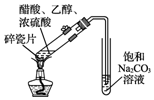 用图装置制取少量乙酸乙酯 | |
| B. | 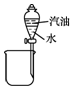 用图装置分离汽油和水 | |
| C. | 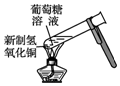 用图装置验证葡萄糖的还原性 | |
| D. | 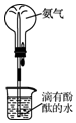 用图装置验证氨气的溶解性和氨水的碱性 |
分析 A.导管在碳酸钠溶液的液面下,可发生倒吸;
B.汽油和水分层;
C.葡萄糖含-CHO,能被氢氧化铜氧化;
D.氨气极易溶于水,且氨水显碱性,溶液变红.
解答 解:A.导管在碳酸钠溶液的液面下,可发生倒吸,应在液面上,故A错误;
B.汽油和水分层,图中分液装置可分离,故B正确;
C.葡萄糖含-CHO,能被氢氧化铜氧化,则图中装置可验证葡萄糖的还原性,故C正确;
D.氨气极易溶于水,且氨水显碱性,溶液变红,则图中装置可验证氨气的溶解性和氨水的碱性,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握图中装置的作用、有机物的制备、混合物分离提纯、性质实验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度中等.

练习册系列答案
相关题目
7.已知:①C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
④C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
下列说法正确的是( )
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
④C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
下列说法正确的是( )
| A. | 将2.4g炭完全转化为水煤气,然后再充分燃烧,整个过程放出热量39.35kJ | |
| B. | C的燃烧热为-110.5kJ/mol | |
| C. | H2的燃烧热为-241.8kJ/mol | |
| D. | 由反应③可知,反应过程中转移5mol电子且生成液态水时放出的热量大于604.5kJ |
8.科技改变生活,充电宝已逐渐成为人们生活中的必需品.某充电宝工作时的总反应式为:V2O3+xLi $?_{充电}^{放电}$ Li4V2O3,下列说法正确的是( )
| A. | 放电时正极上的电极反应为:Li-e-═Li+ | |
| B. | 该充电宝的凝胶介质可用KOH水溶液代替 | |
| C. | 充电时每生成14g Li,凝胶介质中有2mol电子通过 | |
| D. | 充电时电池的正极失电子后Li4V2O3会转化为V2O3 |
5.下列实验操作和现象对应的结论正确的是( )
| 选项 | 实验操作和现象 | 结 论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 2mL10%的CuSO4溶液中滴加2%的NaOH溶液4~6滴制得新制氢氧化铜,再滴加几滴葡萄糖溶液,加热 | 检验葡萄糖中含有醛基 |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)<Ksp(AgI) |
| D | 将Al2(SO4)3溶液蒸干、灼烧至恒重 | 最终剩余固体是Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
12.向铝土矿(含A12O3、FeO、Fe2O3、SiO2)中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通入过量H2S:H+、Fe2+、Al3+、SO42- | |
| B. | 通入过量氨气:NH4+、A1O2-、OH-、SO42- | |
| C. | 加入过量NaC1O溶液:Fe3+、Na+、ClO-、SO42- | |
| D. | 加入过量NaOH溶液:Na+、A1O2-、OH-、SO42-、SiO32- |
2.曙红可用作指示剂及染料,其结构简式如图所示.下列有关曙红的说法正确的是( ) 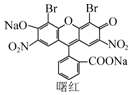

| A. | 不能与盐酸发生反应 | |
| B. | 分子中含1个手性碳原子 | |
| C. | 能发生取代、加成、消去反应 | |
| D. | 1 mol曙红最多能与4 mol NaOH反应 |
6.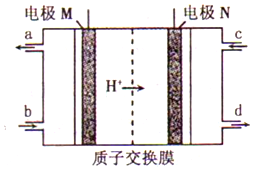 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )| A. | N极为电源负极,联氨从c口通入 | |
| B. | 负极上每消耗lmol N2H4,转移6mol电子 | |
| C. | 正极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 可将联氨改进为引火性低、稳定性好的N2H4•H2O |
7.四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的简单离子半径是同周期主族元素中最小的,四种元素原子的最外层电子数之和为15,下列叙述错误的是( )
| A. | 气态氢化物的热稳定性:b<c | B. | 含d元素的盐溶液可能呈碱性 | ||
| C. | 原子半径:d>c>b>a | D. | a、b和c三种元素能形成离子化合物 |