题目内容
16.氮及氮的化合物有着重要的用途.(1)氮元素在周期表中的位置是第2周期VA族;NH3的电子式是
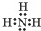 .
.(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO(用化学方程式表示).
(3)工业合成氨是人工固氮的重要方法.2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如图:
下列说法正确的是bc(选填字母).
a.图①表示N2、H2分子中均是单键
b.图②→图③需要吸收能量
c.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266kJ/mol.
分析 (1)氮元素原子序数为7,两个电子层最外层5个电子,根据共价化合物电子式的书写规则书写;
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,如氮气和氢气合成氨、氮气和氧气放电反应生成一氧化氮;
(3)a.氮气分子中是三键;
b.图②是表示N2、H2被吸附在催化剂的表面;图③则表示在催化剂表面,N2、H2中的化学键断裂;
c.在化学变化中,氮分子和氢分子在催化剂的作用下分解成氢原子和氮原子,然后原子又重新组合成新的分子;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
解答 解:(1)氮元素在周期表中的位置是第二周期,ⅤA族,A氨气是共价化合物,各原子间通过共用电子对形成共价键,所以其电子式为: ,
,
故答案为:第2周期VA族,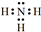 ;
;
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,如氮气和氢气合成氨、氮气和氧气放电反应生成一氧化氮,反应的化学方程式为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
(3)a.图①表示N2、H2分子中不都是单键,氮气是三键,故a错误;
b.分析题中图可以知道,图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂,图②→图③需要吸收能量,故b正确;
c.在化学变化中,氮分子和氢分子在催化剂的作用下分解成氢原子和氮原子,然后原子又重新组合成新的分子,该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成,故c正确;
故答案为:bc;
(4)①N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,
依据盖斯定律计算②×3-①×2得到氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266 kJ/mol,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266 kJ/mol.
点评 本题考查了微粒结构、化学反应实质的理解应用、热化学方程式书写、原电池原理的理解应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol
④C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
下列说法正确的是( )
| A. | 将2.4g炭完全转化为水煤气,然后再充分燃烧,整个过程放出热量39.35kJ | |
| B. | C的燃烧热为-110.5kJ/mol | |
| C. | H2的燃烧热为-241.8kJ/mol | |
| D. | 由反应③可知,反应过程中转移5mol电子且生成液态水时放出的热量大于604.5kJ |
 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:(1)用CO可以合成甲醇.已知:
CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H1kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3kJ•mol-1
则CO(g)+2H2(g)?CH3OH(g)△H=2△H3+△H2-△H1kJ•mol-1.
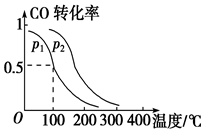
(2)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)?CH3OH(g)△H,平衡转化率与温度、压强的关系如图所示.
p2大于p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
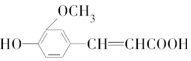 ,符合下列条件的阿魏酸的同分异构体的数目为
,符合下列条件的阿魏酸的同分异构体的数目为①苯环上有两个取代基,且苯环上的一溴代物只有2种;
②能发生银镜反应;
③与碳酸氢钠溶液反应可生成使澄清石灰水变浑浊的气体;
④与FeCl3溶液发生显色反应.( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 放电时正极上的电极反应为:Li-e-═Li+ | |
| B. | 该充电宝的凝胶介质可用KOH水溶液代替 | |
| C. | 充电时每生成14g Li,凝胶介质中有2mol电子通过 | |
| D. | 充电时电池的正极失电子后Li4V2O3会转化为V2O3 |
| 选项 | 实验操作和现象 | 结 论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 2mL10%的CuSO4溶液中滴加2%的NaOH溶液4~6滴制得新制氢氧化铜,再滴加几滴葡萄糖溶液,加热 | 检验葡萄糖中含有醛基 |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)<Ksp(AgI) |
| D | 将Al2(SO4)3溶液蒸干、灼烧至恒重 | 最终剩余固体是Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
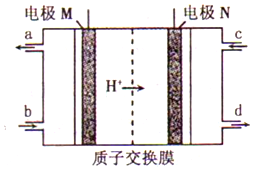 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )| A. | N极为电源负极,联氨从c口通入 | |
| B. | 负极上每消耗lmol N2H4,转移6mol电子 | |
| C. | 正极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 可将联氨改进为引火性低、稳定性好的N2H4•H2O |
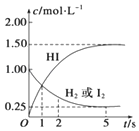 698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题:
698K时,向某V L的密闭容器中充入3mol H2(g)和3mol I2(g),发生反应:H2(g)+I2(g)?2HI(g),测得各物质的物质的量浓度与时间变化的关系如右图所示.请回答下列问题: