题目内容
11.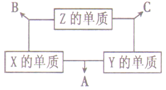 短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )
短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子.下列说法正确的是( )| A. | Y元素位于ⅥA族 | B. | A、B、C都是非电解质 | ||
| C. | C的沸点高于B的沸点 | D. | A和C可发生氧化还原反应 |
分析 B和C均为10电子分子,结合X、Y、Z三种元素的常见单质的相互转化可知,Z的单质为H2,常见的10电子分子(氢化物)有CH4、NH3、H2O、HF,且X的单质与Y的单质反应生成A,Y为N,X为O时,符合短周期元素X、Y、Z,原子序数之和为16,原子半径的大小关系为:r(Y)>r(X)>r(Z),以此来解答.
解答 解:由上述分析可知,Z为H,Y为N,X为O,B为H2O,C为NH3,A为NO,
A.Y为N,位于第二周期VA族,故A错误;
B.B为水,为弱电解质,而B、C为非电解质,故B错误;
C.水中氢键数目多,则C的沸点小于B的沸点,故C错误;
D.C为NH3,A为NO,可发生氧化还原反应生成氮气和水,故D正确;
故选D.
点评 本题考查无机物的推断,为高频考点,把握10电子微粒、相互转化来推断物质及元素为解答的关键,侧重分析与推断能力的考查,注意原子序数之和及原子半径的限制条件,题目难度不大.

练习册系列答案
相关题目
1.阿魏酸的结构简式为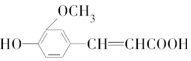 ,符合下列条件的阿魏酸的同分异构体的数目为
,符合下列条件的阿魏酸的同分异构体的数目为
①苯环上有两个取代基,且苯环上的一溴代物只有2种;
②能发生银镜反应;
③与碳酸氢钠溶液反应可生成使澄清石灰水变浑浊的气体;
④与FeCl3溶液发生显色反应.( )
 ,符合下列条件的阿魏酸的同分异构体的数目为
,符合下列条件的阿魏酸的同分异构体的数目为①苯环上有两个取代基,且苯环上的一溴代物只有2种;
②能发生银镜反应;
③与碳酸氢钠溶液反应可生成使澄清石灰水变浑浊的气体;
④与FeCl3溶液发生显色反应.( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.曙红可用作指示剂及染料,其结构简式如图所示.下列有关曙红的说法正确的是( ) 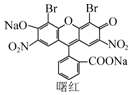

| A. | 不能与盐酸发生反应 | |
| B. | 分子中含1个手性碳原子 | |
| C. | 能发生取代、加成、消去反应 | |
| D. | 1 mol曙红最多能与4 mol NaOH反应 |
19.下列指定反应的离子方程式正确的是( )
| A. | Cl2溶于水:C12+H2O?2H++Cl-+C1O- | |
| B. | 用稀硝酸除去试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | 过量SO2通入饱和的Ca(C1O)2溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+SO42-+4H++2Cl- | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
6.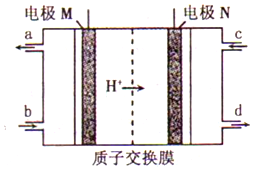 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )| A. | N极为电源负极,联氨从c口通入 | |
| B. | 负极上每消耗lmol N2H4,转移6mol电子 | |
| C. | 正极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 可将联氨改进为引火性低、稳定性好的N2H4•H2O |
16.一种铂(Pt)原子的质量数是196,质子数比中子数少40.该原子的核素符号是( )
| A. | ${\;}_{118}^{78}$Pt | B. | ${\;}_{78}^{118}$Pt | C. | ${\;}_{78}^{196}$Pt | D. | ${\;}_{118}^{196}$Pt |
20.下列反应中,水作氧化剂的是( )
| A. | SO3+H2O→H2SO4 | B. | 2K+2H2O→2KOH+H2↑ | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2Na2O2+2H2O→4NaOH+O2↑ |
13.在生产和生活上应用的含氯消毒剂、漂白剂有多种,如HClO、NaClO、ClO2等.
(1)氯气是合成含氯消毒剂的原料.在催化剂、420℃的条件下,氧气与氯化氢气体反应可置换出氯气,利用表数据写出该反应的热化学方程式O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-133KJ/mol.
(2)氯气溶于水,发生Cl2+H2O═H++Cl-+HC1O,则该反应的平衡常数表达式K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$.下列关于氯水的叙述正确的是AD(填写序号).
A.向氯水中加入少量Na2CO3粉末,其漂白性增强
B.向氯水中通人氯气,c(H+)/c(ClO-)减小
C.加水稀释氯水,溶液中的所有离子浓度均减小
D.加水稀释氯水,水的电离平衡向正反应方向移动
(3)漂白液的有效成分是NaClO,研究漂白液的稳定性对
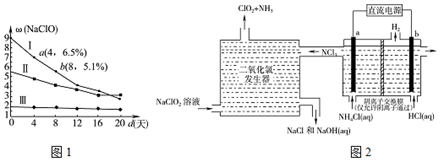
其生产和保存有实际意义.图1是30℃时,三种漂白液中NaClO的质量分数随时间的变化关系.
①分解速率v(I)>v(Ⅱ)(填“>”“<”或“=”)
②漂白液I在4~8天内的分解速率为3.5g'L-l.d-1.(常温下漂白液的密度近似等于1g•cm-3,溶液体积变化忽略不计)
(4)ClO2是一种安全稳定的消毒剂.工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2,原理如图2:
①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体,该分子的电子式为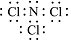 .
.
②电解池中总反应的离子方程式为NH4++2H++3Cl-$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑.
③若电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则理论上b电极上产生氢气的质量为
0.6g.
(1)氯气是合成含氯消毒剂的原料.在催化剂、420℃的条件下,氧气与氯化氢气体反应可置换出氯气,利用表数据写出该反应的热化学方程式O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-133KJ/mol.
| 化学键 | Cl-Cl | O=O | O-H | H-Cl |
| 键能(kJ.mol-1) | 247 | 498 | 463 | 431 |

A.向氯水中加入少量Na2CO3粉末,其漂白性增强
B.向氯水中通人氯气,c(H+)/c(ClO-)减小
C.加水稀释氯水,溶液中的所有离子浓度均减小
D.加水稀释氯水,水的电离平衡向正反应方向移动
(3)漂白液的有效成分是NaClO,研究漂白液的稳定性对
其生产和保存有实际意义.图1是30℃时,三种漂白液中NaClO的质量分数随时间的变化关系.
①分解速率v(I)>v(Ⅱ)(填“>”“<”或“=”)
②漂白液I在4~8天内的分解速率为3.5g'L-l.d-1.(常温下漂白液的密度近似等于1g•cm-3,溶液体积变化忽略不计)
(4)ClO2是一种安全稳定的消毒剂.工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2,原理如图2:
①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体,该分子的电子式为
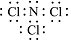 .
.②电解池中总反应的离子方程式为NH4++2H++3Cl-$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑.
③若电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则理论上b电极上产生氢气的质量为
0.6g.
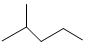 表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.
表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.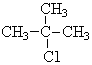 .
.