题目内容
14.常温下,一定浓度的某酸HA溶液的pH=5,下列有关说正确的是( )| A. | 向溶液中加入适量NaA固体,若溶液pH不变,则HA为强酸 | |
| B. | 若HA为弱酸,则该溶液导电能力比等体积pH=5的盐酸弱得多 | |
| C. | 若HA为弱酸,则加入等体积pH=9的NaOH溶液,所得溶液pH>7 | |
| D. | 取该溶液1.00mL,加水稀释至1000mL,所得溶液pH=8 |
分析 A.向溶液中加入适量NaA固体,若溶液pH不变,说明HA不存在电离平衡;
B.溶液的导电能力与溶液中带电粒子的浓度有关;
C.HA为弱酸,溶液中酸的浓度大于氢离子浓度;
D.酸溶液稀释不能变为碱性溶液.
解答 解:A.向溶液中加入适量NaA固体,若溶液pH不变,说明HA不存在电离平衡,所以HA为强酸,故A正确;
B.某酸HA溶液的pH=5,溶液中氢离子的浓度为10-5mol/L,pH=5的盐酸中氢离子的浓度为10-5mol/L,所以两种溶液的导电能力相同,故B错误;
C.HA为弱酸,溶液中酸的浓度大于氢离子浓度,所以加入等体积pH=9的NaOH溶液,酸过量,溶液显酸性,所得溶液pH<7,故C错误;
D.一定浓度的某酸HA溶液的pH=5,该溶液显酸性,酸溶液稀释不能变为碱性溶液,所以稀释后溶液的pH<7,故D错误.
故选A.
点评 本题考查弱电解质的电离和溶液pH的计算,侧重于学生的分析能力的考查,明确弱酸的电离特点是解本题关键,难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
4. 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
(1)用CO可以合成甲醇.已知:
CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H1kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3kJ•mol-1
则CO(g)+2H2(g)?CH3OH(g)△H=2△H3+△H2-△H1kJ•mol-1.
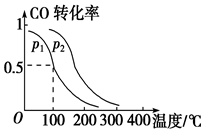
(2)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)?CH3OH(g)△H,平衡转化率与温度、压强的关系如图所示.
p2大于p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:(1)用CO可以合成甲醇.已知:
CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H1kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3kJ•mol-1
则CO(g)+2H2(g)?CH3OH(g)△H=2△H3+△H2-△H1kJ•mol-1.
(2)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)?CH3OH(g)△H,平衡转化率与温度、压强的关系如图所示.
p2大于p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
5.下列实验操作和现象对应的结论正确的是( )
| 选项 | 实验操作和现象 | 结 论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 2mL10%的CuSO4溶液中滴加2%的NaOH溶液4~6滴制得新制氢氧化铜,再滴加几滴葡萄糖溶液,加热 | 检验葡萄糖中含有醛基 |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)<Ksp(AgI) |
| D | 将Al2(SO4)3溶液蒸干、灼烧至恒重 | 最终剩余固体是Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
2.曙红可用作指示剂及染料,其结构简式如图所示.下列有关曙红的说法正确的是( ) 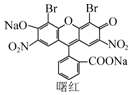

| A. | 不能与盐酸发生反应 | |
| B. | 分子中含1个手性碳原子 | |
| C. | 能发生取代、加成、消去反应 | |
| D. | 1 mol曙红最多能与4 mol NaOH反应 |
19.下列指定反应的离子方程式正确的是( )
| A. | Cl2溶于水:C12+H2O?2H++Cl-+C1O- | |
| B. | 用稀硝酸除去试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | 过量SO2通入饱和的Ca(C1O)2溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+SO42-+4H++2Cl- | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
6.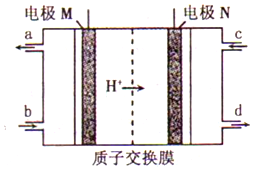 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
 韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )
韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视. 一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示.下列说法正确的是( )| A. | N极为电源负极,联氨从c口通入 | |
| B. | 负极上每消耗lmol N2H4,转移6mol电子 | |
| C. | 正极的电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 可将联氨改进为引火性低、稳定性好的N2H4•H2O |
16.下列关于阿伏伽德罗常数的说法中正确的是( )
| A. | 1 mol氢气含有的原子数为NA | |
| B. | NA个水分子中含有氢原子的物质的量为2 mol | |
| C. | 1 mol 氧气中含有的分子数为2NA | |
| D. | 1 mol任何物质都含有NA个分子 |
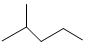 表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.
表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.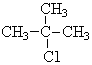 .
.