题目内容
TK时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后达
到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是 ( )
到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
| E、2s内,该反应的平均速率为v(COCl2)=0.175mol?L-1?s-1 |
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:A.由表中数据可知,6s、8s时氯气的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时氯气的浓度为0.2mol.L,升高温度,到达新平衡,氯气的浓度变为0.22mol/L,氯气浓度增大,说明平衡向生成氯气的方向移动;
B.恒容绝热密闭容器进行该反应,随反应进行温度发生变化,而平衡常数只受温度影响;
C.利用三段式计算平衡时各组分的平衡浓度,进而计算平衡常数,再计算此时的浓度商,根据浓度商与平衡常数大小判断反应进行方向,据此判断反应速率;
D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,如加入1.0 mol Cl2和0.8 mol CO,相当于在上述等效平衡的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小;
E.根据v(COCl2)与v(Cl2)=1:1,计算2s内,Cl2平均速率即可.
B.恒容绝热密闭容器进行该反应,随反应进行温度发生变化,而平衡常数只受温度影响;
C.利用三段式计算平衡时各组分的平衡浓度,进而计算平衡常数,再计算此时的浓度商,根据浓度商与平衡常数大小判断反应进行方向,据此判断反应速率;
D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,如加入1.0 mol Cl2和0.8 mol CO,相当于在上述等效平衡的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小;
E.根据v(COCl2)与v(Cl2)=1:1,计算2s内,Cl2平均速率即可.
解答:
解:A.由表中数据可知,6s、8s时氯气的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时氯气的浓度为0.2mol.L,升高温度,到达新平衡,氯气的浓度变为0.22mol/L,氯气浓度增大,说明平衡向正反应方向移动,故正反应为吸热反应,即△H>0,故A错误;
B.正反应为吸热反应,恒容绝热密闭容器进行该反应,随反应进行温度降低,而平衡常数只受温度影响,故平衡常数一定发生变化,故B错误;
C.平衡时c(Cl2)=0.2mol/L,
COCl2(g)?Cl2(g)+CO(g)
起始(mol/L):0.5 0 0
转化(mol/L):0.2 0.2 0.2
平衡(mol/L):0.3 0.2 0.2
该温度下平衡常数k=
=0.013,
若起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,此时Qc=
=0.15>0.13,则反应向逆反应方向移动,反应达到平衡前v正<v逆,故C正确;
D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,达到平衡时Cl2的转化率=
×100%=60%,如加入1.0 mol Cl2和0.8 mol CO,相当于在原来的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小,则Cl2的转化率小于60%,故D正确.
E.根据v(COCl2)与v(Cl2)=1:1,则2s内,Cl2平均速率=
=0.075mol?L-1?s-1,所以v(COCl2)=0.075mol?L-1?s-1,故E错误;
故选CD.
B.正反应为吸热反应,恒容绝热密闭容器进行该反应,随反应进行温度降低,而平衡常数只受温度影响,故平衡常数一定发生变化,故B错误;
C.平衡时c(Cl2)=0.2mol/L,
COCl2(g)?Cl2(g)+CO(g)
起始(mol/L):0.5 0 0
转化(mol/L):0.2 0.2 0.2
平衡(mol/L):0.3 0.2 0.2
该温度下平衡常数k=
| 0.2×0.2 |
| 0.3 |
若起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,此时Qc=
| ||||
|
D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,达到平衡时Cl2的转化率=
| 1mol-0.4mol |
| 1mol |
E.根据v(COCl2)与v(Cl2)=1:1,则2s内,Cl2平均速率=
| ||
| 2 |
故选CD.
点评:本题综合考查化学平衡的计算、等效平衡,难度较大,注意理解平衡常数的意义及应用,注意D选项中利用等效平衡思想进行解答.

练习册系列答案
相关题目
常温下,相同物质的量浓度的下列溶液中,pH最小的是( )
| A、KOH |
| B、NH3?H2O |
| C、HCl |
| D、H2SO4 |
将0.2mol?L-1的偏铝酸钠溶液和0.4mol?L-1的盐酸等体积混合,混合液中离子浓度由大到小的顺序是( )
| A、[Cl-]>[Al3+]>[Na+]>[H+]>[OH-] |
| B、[Cl-]>[Na+]>[Al3+]>[H+]>[OH-] |
| C、[Cl-]>[Al3+]>[Na+]>[OH-]>[H+] |
| D、[Na+]>[Cl-]>[Al3+]>[OH-]=[H+] |
硝酸发生氧化还原反应时,硝酸浓度越稀,对应还原产物中氮元素化合价越低,现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐渐加入5mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.则下列叙述错误的是( )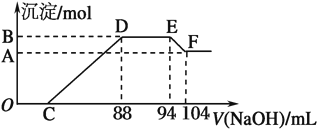

| A、DE段方程式为NH4++OH-=NH3?H2O |
| B、原硝酸溶液中含硝酸的物质的量为0.47 mol |
| C、C点对应的溶液体积为40 mL |
| D、混合物中铝粉与铁粉的物质的量之比为5:3 |
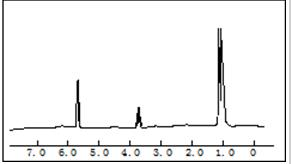 某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题:
某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题:
 (1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于
(1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于