题目内容
硝酸发生氧化还原反应时,硝酸浓度越稀,对应还原产物中氮元素化合价越低,现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐渐加入5mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.则下列叙述错误的是( )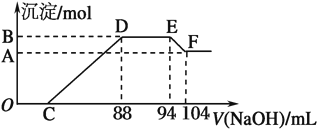

| A、DE段方程式为NH4++OH-=NH3?H2O |
| B、原硝酸溶液中含硝酸的物质的量为0.47 mol |
| C、C点对应的溶液体积为40 mL |
| D、混合物中铝粉与铁粉的物质的量之比为5:3 |
考点:氧化还原反应的计算
专题:计算题
分析:①先加入NaOH溶液时没有沉淀生成,说明NaOH先和溶液中酸反应,则硝酸有剩余,根据 HNO3+NaOH=NaNO3+H2O计算剩余硝酸的物质的量;
②硝酸有剩余,所以溶液中存在铁离子,继续滴加NaOH溶液有沉淀生成,发生反应Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,所以随着NaOH的加入,沉淀的物质的量逐渐增加;
③当88mL时沉淀物质的量最大,继续滴加NaOH,沉淀的物质的量不变,说明发生反应 NH4++OH-=NH3.H2O;
④当加入94mL溶液后,继续滴加NaOH溶液,沉淀的物质的量减小,发生反应 Al(OH)3+OH-=AlO2-+2H2O,据此分析解答.
②硝酸有剩余,所以溶液中存在铁离子,继续滴加NaOH溶液有沉淀生成,发生反应Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,所以随着NaOH的加入,沉淀的物质的量逐渐增加;
③当88mL时沉淀物质的量最大,继续滴加NaOH,沉淀的物质的量不变,说明发生反应 NH4++OH-=NH3.H2O;
④当加入94mL溶液后,继续滴加NaOH溶液,沉淀的物质的量减小,发生反应 Al(OH)3+OH-=AlO2-+2H2O,据此分析解答.
解答:
解:①先加入NaOH溶液时没有沉淀生成,说明NaOH先和溶液中酸反应,则硝酸有剩余,根据 HNO3+NaOH=NaNO3+H2O得剩余n(HNO3);
②硝酸有剩余,所以铁被氧化为铁离子,继续滴加NaOH溶液有沉淀生成,发生反应Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,所以随着NaOH的加入,沉淀的物质的量逐渐增加;
③当88mL时沉淀物质的量最大,继续滴加NaOH,沉淀的物质的量不变,说明发生反应 NH4++OH-=NH3.H2O;
④当加入94mL溶液后,继续滴加NaOH溶液,沉淀的物质的量减小,发生反应 Al(OH)3+OH-=AlO2-+2H2O,
A.通过以上分析知,DE段方程式为NH4++OH-=NH3?H2O,故A正确;
B.当NaOH溶液体积为94mL时,溶液中的溶质为NaNO3,根据Na原子守恒、硝酸根离子守恒得n(NaNO3)=n(NaOH)=n(HNO3)=0.094L×5mol/L=0.47mol,反应中还有生成铵根离子的硝酸,其物质的量等于n(NH4+)=0.006L×5mol/L=0.03mol,所以一共消耗硝酸0.5mol,故B错误;
C.EF段发生反应Al(OH)3+OH-=AlO2-+2H2O,根据方程式知n(Al(OH)3)=0.01L×5mol/L=0.05mol,根据Al原子守恒得n(Al)=n(Al(OH)3)=0.05mol,
根据NH4++OH-=NH3.H2O得n(NH4+)=n(OH-)=0.006L×5mol/L=0.03mol,
因为没有气体生成,所以硝酸根离子发生还原反应生成铵根离子,因为根据转移电子守恒得3n(Fe)+3n(Al)=8n(NH4+),3n(Fe)+0.05mol×3=0.03mol×8,n(Fe)=0.03mol,根据Al3++3 OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓知铝离子、铁离子消耗n( OH-)=3n(Fe)+3n(Al)=3(0.03mol+0.05mol)=0.24mL,则V(NaOH)=
=0.048mL,剩余为和硝酸反应的NaOH,则C点数值88mL-48mL=40mL,故C正确;
D.通过以上分析知,n(Fe)=0.03mol,n(Al)=0.05mol,所以混合物中铝粉与铁粉的物质的量之比为5:3,故D正确;
故选B.
②硝酸有剩余,所以铁被氧化为铁离子,继续滴加NaOH溶液有沉淀生成,发生反应Al3++3OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓,所以随着NaOH的加入,沉淀的物质的量逐渐增加;
③当88mL时沉淀物质的量最大,继续滴加NaOH,沉淀的物质的量不变,说明发生反应 NH4++OH-=NH3.H2O;
④当加入94mL溶液后,继续滴加NaOH溶液,沉淀的物质的量减小,发生反应 Al(OH)3+OH-=AlO2-+2H2O,
A.通过以上分析知,DE段方程式为NH4++OH-=NH3?H2O,故A正确;
B.当NaOH溶液体积为94mL时,溶液中的溶质为NaNO3,根据Na原子守恒、硝酸根离子守恒得n(NaNO3)=n(NaOH)=n(HNO3)=0.094L×5mol/L=0.47mol,反应中还有生成铵根离子的硝酸,其物质的量等于n(NH4+)=0.006L×5mol/L=0.03mol,所以一共消耗硝酸0.5mol,故B错误;
C.EF段发生反应Al(OH)3+OH-=AlO2-+2H2O,根据方程式知n(Al(OH)3)=0.01L×5mol/L=0.05mol,根据Al原子守恒得n(Al)=n(Al(OH)3)=0.05mol,
根据NH4++OH-=NH3.H2O得n(NH4+)=n(OH-)=0.006L×5mol/L=0.03mol,
因为没有气体生成,所以硝酸根离子发生还原反应生成铵根离子,因为根据转移电子守恒得3n(Fe)+3n(Al)=8n(NH4+),3n(Fe)+0.05mol×3=0.03mol×8,n(Fe)=0.03mol,根据Al3++3 OH-=Al(OH)3↓、Fe3++3OH-=Fe(OH)3↓知铝离子、铁离子消耗n( OH-)=3n(Fe)+3n(Al)=3(0.03mol+0.05mol)=0.24mL,则V(NaOH)=
| 0.24mol |
| 5mol/L |
D.通过以上分析知,n(Fe)=0.03mol,n(Al)=0.05mol,所以混合物中铝粉与铁粉的物质的量之比为5:3,故D正确;
故选B.
点评:本题考查氧化还原反应、离子方程式的计算,明确图片中各个阶段发生的反应是解本题关键,知道各个拐点溶液中对应的溶质,再结合方程式、原子守恒进行解答,易错选项是B,注意消耗的硝酸还包含被还原的硝酸,为易错点.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
在Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O反应中( )
| A、参加反应的硝酸和作氧化剂的硝酸质量比为2:1 |
| B、硝酸都用作氧化剂 |
| C、每个硝酸分子得到2个电子 |
| D、硝酸铜是氧化产物 |
TK时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后达
到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是 ( )
到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
| E、2s内,该反应的平均速率为v(COCl2)=0.175mol?L-1?s-1 |
 下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题:
下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,且反应③中有O2产生,回答问题: 几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.
几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.
 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )