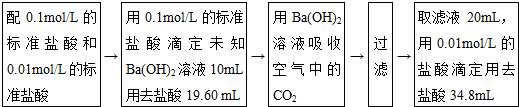
题目内容
W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素.
(1)Y元素在周期表中的位置是 ,比Z元素原子序数大18的元素名称为 .
(2)W、X、Z各自的最高价氧化物对应的水化物可以两两反应,反应的离子方程式为 、 、
.
(3)W与Y 可形成化合物W2Y2,该化合物中含有的化学键类型有 .
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式 .
(5)Y、Z气态氢化物的还原性由强到弱排列为: (用分子式表示).
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: .
(7)已知Z的最高价氧化物是一种酸性氧化物,该氧化物是一种无色液体,该物质与一定量水混合得到一种稀溶液,写出该反应的化学方程式: .
(1)Y元素在周期表中的位置是
(2)W、X、Z各自的最高价氧化物对应的水化物可以两两反应,反应的离子方程式为
(3)W与Y 可形成化合物W2Y2,该化合物中含有的化学键类型有
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式
(5)Y、Z气态氢化物的还原性由强到弱排列为:
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
(7)已知Z的最高价氧化物是一种酸性氧化物,该氧化物是一种无色液体,该物质与一定量水混合得到一种稀溶液,写出该反应的化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素,W、X、Z各自的最高价氧化物对应的水化物可以两两反应,则X为铝元素,W为钠元素,W、X、Y、Z均为第三周期元素,W与Y 可形成化合物W2Y2,则Y为硫元素,Z的原子序数比Y大,所以Z为氯元素,据此答题.
解答:
解:W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素,W、X、Z各自的最高价氧化物对应的水化物可以两两反应,则X为铝元素,W为钠元素,W、X、Y、Z均为第三周期元素,W与Y 可形成化合物W2Y2,则Y为硫元素,Z的原子序数比Y大,所以Z为氯元素,
(1)由上面分析可知,Y为硫元素,在周期表中第三周期第ⅤⅠA族,Z为氯元素,原子序数比氯大18的元素名称为溴元素,
故答案为:第三周期第ⅤⅠA族;溴;
(2)W、X、Z各自的最高价氧化物对应的水化物分别为Al(OH)3、NaOH、HClO4,它们可以两两的离子方程式为 Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+═Al3++3H2O、H++OH-=H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+═Al3++3H2O、H++OH-=H2O;
(3)W与Y 可形成化合物Na2S2,该化合物中含有的化学键类型有离子键和非极性键,
故答案为:离子键和非极性键;
(4)二氧化硫通入氯水中,反应的化学方程式为SO2+Cl2+2H2O═2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O═2HCl+H2SO4;
(5)因为氯的非金属性强于硫,所以硫化氢的还原性强于氯化氢,
故答案为:H2S>HCl;
(6)电子层数越多,离子半径越大,电子层数相同时,核电荷数越多,离子半径越小,所以W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:S2->Cl->Na+>Al3+,
故答案为:S2->Cl->Na+>Al3+;
(7)Z为氯元素,它的最高价氧化物为是一种酸性氧化物为Cl2O7,与一定量水混合得到一种稀溶液,为高氯酸溶液,该反应的化学方程式为Cl2O7+H2O═2HClO4,
故答案为:Cl2O7+H2O═2HClO4;
(1)由上面分析可知,Y为硫元素,在周期表中第三周期第ⅤⅠA族,Z为氯元素,原子序数比氯大18的元素名称为溴元素,
故答案为:第三周期第ⅤⅠA族;溴;
(2)W、X、Z各自的最高价氧化物对应的水化物分别为Al(OH)3、NaOH、HClO4,它们可以两两的离子方程式为 Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+═Al3++3H2O、H++OH-=H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+═Al3++3H2O、H++OH-=H2O;
(3)W与Y 可形成化合物Na2S2,该化合物中含有的化学键类型有离子键和非极性键,
故答案为:离子键和非极性键;
(4)二氧化硫通入氯水中,反应的化学方程式为SO2+Cl2+2H2O═2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O═2HCl+H2SO4;
(5)因为氯的非金属性强于硫,所以硫化氢的还原性强于氯化氢,
故答案为:H2S>HCl;
(6)电子层数越多,离子半径越大,电子层数相同时,核电荷数越多,离子半径越小,所以W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:S2->Cl->Na+>Al3+,
故答案为:S2->Cl->Na+>Al3+;
(7)Z为氯元素,它的最高价氧化物为是一种酸性氧化物为Cl2O7,与一定量水混合得到一种稀溶液,为高氯酸溶液,该反应的化学方程式为Cl2O7+H2O═2HClO4,
故答案为:Cl2O7+H2O═2HClO4;
点评:本题主要考查了元素周期表、元素周期律、化学键、半径比较、元素化合物知识等,中等难度,解题的关键是元素推断,答题时注意化学用语的规范表达.

练习册系列答案
相关题目
TK时,向2.0 L恒容密闭容器中充入1.0 mol COCl2,反应COCl2(g)?Cl2(g)+CO(g),经过一段时间后达
到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是 ( )
到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
| E、2s内,该反应的平均速率为v(COCl2)=0.175mol?L-1?s-1 |
 如图为周期表中短周期的一部分,若A原子最外层电子数比次外层电子数少3,则下列说法中不正确的是( )
如图为周期表中短周期的一部分,若A原子最外层电子数比次外层电子数少3,则下列说法中不正确的是( )| A、D的单质可跟B的氢化物的水溶液反应 |
| B、A、C可形成化合物AC5,分子中各原子均满足最外层8电子结构 |
| C、原子半径A>B>C |
| D、C的最高价氧化物对应水化物比B的最高价氧化物对应水化物的酸性强 |
杨老师在课堂上出示两瓶失去标签的Na2CO3和NaHCO3无色饱和溶液,希望班里同学提出简便的鉴别方法,该班同学踊跃提出看法,其中合理的是( )
| A、取同量的溶液于两支试管中,各滴入酚酞试液,红色较深的是Na2CO3 |
| B、取同量的溶液于两支试管中,加热,有气泡产生的是NaHCO3 |
| C、取同量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是NaHCO3 |
| D、取同量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3 |
甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有什么试剂的洗气瓶( )
| A、澄清石灰水、浓H2SO4 |
| B、KMnO4酸性溶液、浓H2SO4 |
| C、溴水、浓H2SO4 |
| D、浓H2SO4、KMnO4酸性溶液 |
如图所示,6个编号分别表示六种物质:
Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3.),图中⑤表示的物质是( )
Al、Fe2O3、NaOH溶液、氢碘酸、NH3、O2凡是直线相连的两种物质均能发生化学反应(已知高温时氨气能还原Fe2O3.),图中⑤表示的物质是( )

| A、Al或Fe2O3 |
| B、NaOH溶液 |
| C、氢碘酸 |
| D、NH3或O2 |
下列有关物质用途的说法中,正确的是( )
| A、浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 |
| B、硝酸常用作金属铜加工前的酸洗 |
| C、碳酸钠可用于治疗胃酸过多 |
| D、三氧化二铁常用于生产红色油漆和涂料 |
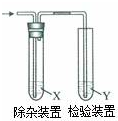 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )