题目内容
今有室温下四种溶液,有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A、①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 |
| B、分别加水稀释10倍,四种溶液的pH:①>②>④>③ |
| C、①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、VaL④与VbL②溶液混合后,若混合后溶液pH=7,则Va:Vb=1:11 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A.氨水中存在电离平衡,加氯化铵晶体抑制其电离,而氢氧化钠溶液中加氯化铵晶体发生反应;
B.强酸、强碱稀释10倍,pH变化1,而弱酸、弱碱稀释10倍,pH变化小于1;
C.①、④两溶液等体积混合,溶液中氨水过量,溶质为氯化铵和一水合氨,溶液显碱性;
D.若混合后溶液pH=7,则溶液显中性,利用酸的物质的量、碱的物质的量来计算pH.
B.强酸、强碱稀释10倍,pH变化1,而弱酸、弱碱稀释10倍,pH变化小于1;
C.①、④两溶液等体积混合,溶液中氨水过量,溶质为氯化铵和一水合氨,溶液显碱性;
D.若混合后溶液pH=7,则溶液显中性,利用酸的物质的量、碱的物质的量来计算pH.
解答:
解:A.氨水中存在电离平衡,加氯化铵晶体抑制其电离,氢氧根离子的浓度变小,则pH减小,而氢氧化钠溶液中加氯化铵晶体发生反应生成氯化钠和一水合氨,碱性减弱,pH减小,故A正确;
B.强酸、强碱稀释10倍,pH变化1,则稀释10倍时②的pH=10,④的pH=4,而弱酸、弱碱稀释10倍,pH变化小于1,则①的10<pH<11,③的3<pH<4,即分别加水稀释10倍四种溶液的pH为①>②>④>③,故B正确;
C.①、④两溶液等体积混合,溶液中氨水过量,溶质为氯化铵和一水合氨,溶液显碱性,氨水的电离大于铵根离子的水解,则c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.若混合后溶液pH=7,则恰好完全中和,则Va×0.001mol/L-Vb×0.001mol/L=0,解得Va:Vb=1:1,故D错误;
故选CD.
B.强酸、强碱稀释10倍,pH变化1,则稀释10倍时②的pH=10,④的pH=4,而弱酸、弱碱稀释10倍,pH变化小于1,则①的10<pH<11,③的3<pH<4,即分别加水稀释10倍四种溶液的pH为①>②>④>③,故B正确;
C.①、④两溶液等体积混合,溶液中氨水过量,溶质为氯化铵和一水合氨,溶液显碱性,氨水的电离大于铵根离子的水解,则c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.若混合后溶液pH=7,则恰好完全中和,则Va×0.001mol/L-Vb×0.001mol/L=0,解得Va:Vb=1:1,故D错误;
故选CD.
点评:本题考查离子浓度的比较、弱电解质的电离、pH的有关计算,综合性较强,难度较大,注意电离与水解的相互结合来分析解答.

练习册系列答案
相关题目
某化合物由碳、氢、氧三种元素组成,其红外光谱图有C-H键、H-O键、C-O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式可能是( )
| A、CH3CH2CH2OH |
B、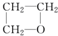 |
| C、CH3CH2OCH3 |
| D、CH3CH2CHO |
下列关于电解质溶液的叙述正确的是( )
| A、常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| B、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D、常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
化学与生产、生活、社会密切相关.下列说法中正确的是( )
| A、合金材料中可能含有非金属元素 |
| B、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| C、二氧化硫和氯水均具有漂白性,可将两者混合使用增强漂白效果 |
| D、氮化硅陶瓷、光导纤维、石英玻璃都属于新型无机非金属材料 |
 粗镍经过下列过程可以转化为纯度99.9%的高纯镍,管状反应装置如图.
粗镍经过下列过程可以转化为纯度99.9%的高纯镍,管状反应装置如图.管中发生的反应是Ni(s)+4CO(g)
| 50℃-180℃ |
| 180℃-200℃ |
下列说法不正确的是( )
| A、反应管粗镍端为低温区,高纯镍端为高温区 |
| B、该反应体系在一定条件下达到平衡状态的标志之一是体系的压强不变 |
| C、提纯过程中,CO会逐渐减少 |
| D、该装置可用于碘的提纯 |
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O反应中,下列说法正确的是( )
| A、Cl2是还原产物 |
| B、HCl全部被还原 |
| C、KMnO4被氧化 |
| D、HCl既表现还原性又表现酸性 |