题目内容
1.下列物质:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CO中存在配位键的是( )| A. | ①② | B. | ①②③ | C. | ③④⑤ | D. | ①②⑤ |
分析 在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键,
①氢离子提供空轨道,氧原子提供孤电子对;
②铜离子提供空轨道,氮原子提供孤电子对;
③CH3COO- 中碳和氧最外层有8个电子达到稳定结构,氢满足2电子稳定结构,无空轨道,无孤电子对;
④NH3为共价化合物,氮原子中最外层有8个电子达到稳定结构,分子中存在两个H-N键,氢满足2电子稳定结构,无空轨道;
⑤CO为共价化合物,分子中氧提供孤电子对,碳提供空轨道.
解答 解:①H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;
②Cu2+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,[Cu(NH3)4]2+ 含有配位键;
③CH3COO- 中碳和氧最外层有8个电子达到稳定结构,氢满足2电子稳定结构,无空轨道,无孤电子对,电子式为 ,不含有配位键;
,不含有配位键;
④NH3为共价化合物,氮原子中最外层有8个电子达到稳定结构,分子中存在两个H-N键,氢满足2电子稳定结构,无空轨道;
⑤CO为共价化合物,分子中氧提供孤电子对,碳提供空轨道;
故选D.
点评 本题考查配位键的判断,明确配位键的形成是解本题关键,题目难度中等.注意配位键形成的条件,一方要提供空轨道,另一方提供孤电子对.

练习册系列答案
相关题目
11.X、Y、Z、R是短周期主族元素,X原子最外层电子数为电子总数的2/3,Y原子最外层电子数是内层电子数的3倍,Z元素的单质常温下能与水反应产生氢气,R原子的核外电子数是X原子与Z原子的核外电子数之和.下列叙述正确的是( )
| A. | 原子半径的大小顺序:X>Y>Z>R | |
| B. | 最高价氧化物的水化物的酸性:R>X | |
| C. | 氢化物的稳定性:X>Y | |
| D. | Y与Z形成的两种化合物中的化学键和晶体类型均相同 |
12.下列物质可用铁制容器盛装的是( )
| A. | 亚硫酸 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 胆矾溶液 |
9.下列化合物均为天然萜类化合物:

对这些萜类化合物叙述错误的是( )

对这些萜类化合物叙述错误的是( )
| A. | 三种化合物中只有a 和c 互为同分异构体 | |
| B. | 一定条件下a 和b可相互转化 | |
| C. | 三种化合物均易被氧化 | |
| D. | 三种化合物均可催化氢化 |
13.短周期元素的性质递变规律如图所示,下列说法正确的是( )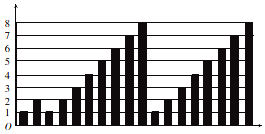

| A. | 横坐标为质子数,纵坐标为元素的最高正价 | |
| B. | 横坐标为原子序数,纵坐标为元素原子的最外层电子数 | |
| C. | 横坐标为核电荷数,纵坐标为元素原子的半径 | |
| D. | 横坐标为中子数,纵坐标为元素的非金属性 |
10.下列实验装置或者操作正确的是 ( )

| A. | 排空气法收集氨气 | B. | 制氨水 | ||
| C. | 除二氧化碳中的少量二氧化硫 | D. | 干燥NH3 |

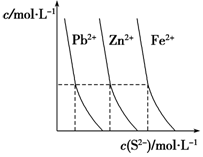 高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题:
高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题: