题目内容
13.短周期元素的性质递变规律如图所示,下列说法正确的是( )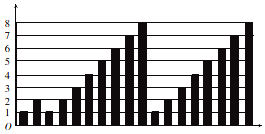
| A. | 横坐标为质子数,纵坐标为元素的最高正价 | |
| B. | 横坐标为原子序数,纵坐标为元素原子的最外层电子数 | |
| C. | 横坐标为核电荷数,纵坐标为元素原子的半径 | |
| D. | 横坐标为中子数,纵坐标为元素的非金属性 |
分析 A.O、F无正价;
B.第二、三周期元素,同周期元素从左到右,最外层电子数逐渐增多;
C.同周期元素从左到右,原子半径逐渐减小;
D.元素的非金属性与中子数无关.
解答 解:A.O、F的非金属性较强,难以失去电子,无正价,故A错误;
B.第二、三周期元素,同周期元素从左到右,最外层电子数逐渐增多,分别从1到8,故B正确;
C.同周期元素从左到右,原子半径逐渐减小,故C错误;
D.元素的非金属性随着核电荷数的增加而周期性变化,与中子数无关,故D错误.
故选B.
点评 本题考查元素周期表与周期律知识,为高频考点,侧重于学生的分析能力的考查,注意把握元素的性质的递变规律,难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
1.下列物质:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CO中存在配位键的是( )
| A. | ①② | B. | ①②③ | C. | ③④⑤ | D. | ①②⑤ |
5. Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
 Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )| A. | MW6中各原子核外均满足8电子稳定结构 | |
| B. | Q、W的单核离子的核外电子数相等 | |
| C. | 五种元素均能形成氢化物 | |
| D. | W的氢化物水溶液酸性最强,说明W的非金属性在五种元素中最强 |
7.表中数据是对应物质的熔点(℃),据此做出的下列判断中正确的是( )
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 180 | 1291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2073 | -57 | 1723 |
| A. | 铝的化合物的晶体中有的是离子晶体 | |
| B. | 表中只有 BCl3和干冰是分子晶体 | |
| C. | 同族元素的氧化物只能形成同类型的晶体 | |
| D. | 不同族元素的氧化物不能形成相同类型晶体 |
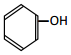 ②
②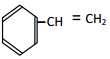 ③
③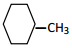 ④
④ ⑤
⑤ ⑥
⑥
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.