题目内容
15. 高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题:
高中化学涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,它们在工农业生产中都有广泛的应用.请回答下列问题:Ⅰ、化学平衡
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l)
(1)该反应的化学平衡常数表达式K=$\frac{1}{{c}^{2}(N{H}_{3})c(C{O}_{2})}$.
(2)取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒压下充入气体He,CO(NH2)2(l)的质量减小(填“增加”“减小”或“不变”).
Ⅱ、电离平衡、水解平衡
(1)某温度下,纯水中c(H+)=2.0×10-7 mol•L-1,该温度下,0.09mol•L-1 NaOH溶液与0.01mol•L-1 HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=12.
(2)向100mL 0.10mol•L-1 CH3COOH的溶液中加入0.010mol CH3COONa(s),已知该混合溶液中c(Na+)<c(CH3COO-),则CH3COOH的电离程度>CH3COO-的水解程度(填“>”“<”或“=”).
Ⅲ、溶解平衡
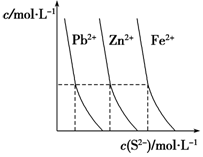
(1)如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液c(S2-)、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是FeS(填化学式).
(2)在20℃时的FeS饱和溶液中,已知Ksp(FeS)=8.1×10-17,c2(H+)•c(S2-)=1.0×10-22,欲使溶液里c(Fe2+)=0.81mol/L,现欲控制溶液中的pH=3.
分析 Ⅰ、化学平衡
(1)平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,注意纯液体和固体不写入;
(2)恒温恒压条件下,充入稀有气体,体积增大,压强减小,反应体系中各组分的浓度减小,平衡向气体体积增大的方向进行;
Ⅱ.电离平衡、水解平衡
(1)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-),先计算出过量的c(OH-),再结合Kw计算c(H+),得出反应后的溶液的pH;
(2)存在CH3COOH?H++CH3COO-电离平衡,氢离子浓度减小则pH增大;该混合溶液中c (Na+)<c (CH3COO-),则水解小于电离;
Ⅲ.(1)根据图2判断出PbS(s)、ZnS(s)、FeS(s)的溶度积、溶解度大小,溶解度越大,加入盐酸后先溶解;
(2)根据硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度,最后利用pH计算公式计算溶液的pH.
解答 解:Ⅰ.(1)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(l),平衡常数K=$\frac{1}{{c}^{2}(N{H}_{3})c(C{O}_{2})}$,
故答案为:$\frac{1}{{c}^{2}(N{H}_{3})c(C{O}_{2})}$;
(2)达到平衡时,在恒温恒压条件下充入稀有气体,体积增大,压强减小各组分的浓度减小,则化学平衡向气体体积增大方向移动,逆向进行CO(NH2)2(l)的质量减小,
故答案为:减小;
Ⅱ.(1)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-)=4×10-14,过量的c(OH-)=$\frac{0.09V-0.01V}{2V}$=0.04mol/L,
由该温度下的Kw可知,c(H+)=$\frac{4×1{0}^{-14}}{0.04}$mol/L=10-12mol•L-1,所以pH=12,
故答案为:12;
(2)存在CH3COOH?H++CH3COO-电离平衡,加入CH3COONa固体,c (CH3COO-)增大,则平衡逆向移动,抑制醋酸电离,溶液氢离子浓度减小则pH增大,
该混合溶液中c (Na+)<c (CH3COO-),则醋酸根离子的水解程度小于其电离程度,所以c(CH3COOH)<c (CH3COO-),
故答案为:>;
Ⅲ.(1)根据图可知,PbS(s)、ZnS(s)、FeS(s)的溶度积大小关系为:Ksp(PbS)<Ksp(ZnS)<Ksp(FeS),则溶解度PbS<ZnS<FeS,如果向三种沉淀中加盐酸,最先溶解的是溶解度最大的FeS,
故答案为:FeS;
(2)将适量FeS 投入H2S 饱和溶液中,c(Fe2+)达到0.81mol/L,溶液中c(S2-)=$\frac{Ksp}{c(F{e}^{2+})}$=$\frac{8.1×1{0}^{-17}}{0.81}$mol/L=1×10-16mol/L,c2(H+)•c(S2-)=1.0×10-22,则c(H+)=$\sqrt{\frac{1×1{0}^{-22}}{1×1{0}^{-16}}}$mol/L=1×10-3mol/L,pH=-lg1×10-3=3,
故答案为:3.
点评 本题考查了化学平衡影响因素、酸碱混合定性判断及溶液酸碱性与溶液pH的计算、难溶物溶解平衡及沉淀转化等知识,题目难度较大,试题题量较大,考查较为综合,注意明确水的电离、弱电解质的电离、盐类水解、难溶物溶解平衡等知识即可解答,注意混合后溶液中的溶质判断为解答的关键,试题充分培养了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | ①② | B. | ①②③ | C. | ③④⑤ | D. | ①②⑤ |
| 元素 | 各电子层的电子数 | |||
| K | L | M | N | |
| A | 2 | 7 | ||
| B | 2 | 8 | 1 | |
| C | 2 | 8 | 18 | 7 |
| D | 2 | 8 | 2 | |
| E | 2 | 8 | 7 | |
(2)属于同一主族的元素是A、C、E.
(3)B单质与水反应的化学反应方程式是2Na+2H2O=2NaOH+H2↑.
(4)E单质与水反应的化学反应方程式是Cl2+H2O=HCl+HClO.
| A. | 在相同的条件下,红磷比白磷稳定 | |
| B. | 在相同的条件下,白磷比红磷稳定 | |
| C. | 红磷和白磷的化学性质相同 | |
| D. | 红磷容易发生自燃而白磷则不会自燃 |
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 180 | 1291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2073 | -57 | 1723 |
| A. | 铝的化合物的晶体中有的是离子晶体 | |
| B. | 表中只有 BCl3和干冰是分子晶体 | |
| C. | 同族元素的氧化物只能形成同类型的晶体 | |
| D. | 不同族元素的氧化物不能形成相同类型晶体 |
| A. | 原子序数:A<B<C | B. | 原子半径:A>B>C | ||
| C. | 离子半径:A2->C->B2+ | D. | 原子核外最外层电子数:A>C>B |
| A. | CO | B. | CH4 | C. | SO3 | D. | H2S |