题目内容
20.研究工业废弃物的处理和防治具有重要的意义.(1)利用反应CH4+2NO2 $\frac{\underline{\;催化剂\;}}{\;}$N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是NO2,当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理1molNO2.
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体.该反应的化学方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(3)某工厂排放的工业废水中可能含有Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑制得Fe2O3、Al2O3和金属Cu,过程如下.
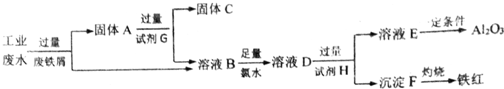
①固体A的成分是Fe、Cu.(填化学式)
②溶液B中的阳离子有Fe3+、Al3+、Fe2+.
③D与过量H溶液反应生成E的离子方程式是Al3++4OH-═AlO2-+2H2O.
④溶液E焰色呈黄色,试剂H是NaOH溶液.
分析 (1)根据元素化合价的变化来判断氧化剂的化合价降低;根据反应方程式分析判断;
(2)在催化剂条件下NO和CO反应,生成CO2和N2;
(3)由流程可知,某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,先加过量铁2Fe3++Fe═3Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,发生Fe+Cu2+═Cu+2Fe2+,由于铁过量,可知固体A中含Fe和Cu;试剂G为盐酸,Cu与盐酸不反应,则固体C为Cu,溶液B中含Fe3+、Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,2Fe2++Cl2=2Fe3++2Cl-;再加过量D生成沉淀F和溶液E,则D为强碱溶液,溶液E为偏铝酸盐,沉淀F为Fe(OH)3,以此进行解答.
解答 解:(1)二氧化氮中氮由+4价变成0价,所以二氧化氮是氧化剂,据反应CH4+2NO2$\frac{\underline{\;催化剂\;}}{\;}$N2+CO2+2H2O可知1mol的甲烷消耗2mol的二氧化氮,所以当消耗CH4的体积是11.2L(标准状况下)时,理论上可处理1molNO2,
故答案为:NO2;1;
(2)在催化剂条件下NO和CO反应,生成CO2和N2,反应的方程式为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(3)由流程可知,某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,先加过量铁2Fe3++Fe═3Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,发生Fe+Cu2+═Cu+2Fe2+,由于铁过量,可知固体A中含Fe和Cu;试剂G为盐酸,Cu与盐酸不反应,则固体C为Cu,溶液B中含Fe3+、Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,2Fe2++Cl2=2Fe3++2Cl-;再加过量D生成沉淀F和溶液E,则D为强碱溶液,溶液E为偏铝酸盐,沉淀F为Fe(OH)3,
①由上述分析可知,A为Fe和Cu,
故答案为:Fe、Cu;
②溶液B中的金属阳离子有:Fe3+、Al3+、Fe2+,
故答案为:Fe3+、Al3+、Fe2+;
③D与过量H溶液反应生成E的离子方程式是:Al3++4 OH-═AlO2-+2H2O,
故答案为:Al3++4 OH-═AlO2-+2H2O;
④E为偏铝酸盐,且溶液E焰色呈黄色,则E为偏铝酸钠,故H为NaOH溶液,
故答案为:NaOH溶液.
点评 本题考查了物质分离与提纯方法、氧化还原反应、化学方程式书写等知识,题目难度中等,明确常见物质分离与提纯方法为解答关键,试题知识点较多、综合性较强,充分考查学生的分析能力及化学实验能力.

(1)方案一:如图1装好实验装置,图中小试管用细线吊着,细线的上端拴在细铁丝上.开始时使右端U形管两端红墨水相平.实验开始,向下插细铁丝,使小试管内盐酸和广口瓶内氢氧化钠溶液混合,此时观察到的现象是U形管内液面左边下降、右边升高,原因是盐酸和氢氧化钠发生中和反应放出热量,使瓶内气体温度升高,压强增大.

(2)方案二:该小组借助反应溶液温度的变化来判断反应的发生.如果氢氧化钠溶液与盐酸混合前后有温度的变化,则证明发生了化学反应.该小组同学将不同浓度的氢氧化钠溶液和盐酸各10mL混合,用温度计测量反应前后温度的变化,测得的部分数据如下表:
| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1mol•L-1 | 0.05mol•L-1 | 3.5 |
| 2 | 0.1mol•L-1 | 0.1mol•L-1 | x |
| 3 | 0.2mol•L-1 | 0.2mol•L-1 | 14 |
(3)方案三:该小组还设计了如图2示装置来证明氢氧化钠溶液确实与稀硫酸发生了反应.他们认为若洗气瓶中导管口有气泡冒出,则说明该反应放出热量,从而证明发生了反应.
①实验时,打开分液漏斗活塞,发现导管流出液体不畅,原因可能是没打开分液漏斗上部塞子
②从原理上讲,该实验设计的不合理之处为稀硫酸具有一定的体积,冒出气泡的原因可能是加入稀硫酸的体积引起的.
请你在此实验装置的基础上提出修改方案分液漏斗上口和锥形瓶之间连接一导管.
| A. | 35.7g | B. | 30g | C. | 17g | D. | 9g |
| A. | 1molFe与足量的Cl2反应转移的电子数为2NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | 常温、常压下,22gCO2中含有的氧原子数为NA | |
| D. | 0.11mol/LCaCl2溶液中含氧离子数为0.2NA |
| A. | 温度升高,c(HCO3-)减小 | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变小 | |
| C. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
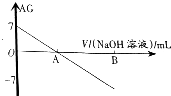 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-5 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(H+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(CH3COOH) |
 ;取代反应
;取代反应 ;加成反应
;加成反应 ;取代反应
;取代反应 ;
;