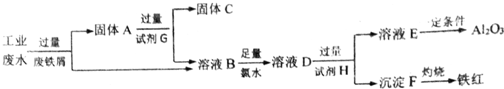
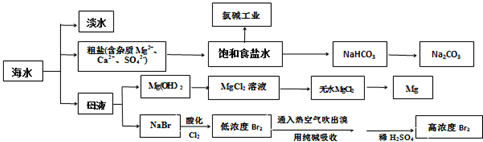
题目内容
9.下列关于0.10mol•L-1NaHCO3溶液的说法正确的是( )| A. | 温度升高,c(HCO3-)减小 | |
| B. | 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变小 | |
| C. | 溶质的电离方程式为NaHCO3═Na++H++CO32- | |
| D. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
分析 A.HCO3-水解为吸热反应,升高温度,促进水解;
B.加水稀释后,促进HCO3-水解,但Kw不变;
C.碳酸氢根离子不可拆分;
D.溶液遵循电荷守恒;
解答 解:A.HCO3-水解为吸热反应,升高温度,促进水解,则c(HCO3-)减小,故A正确;
B.25℃时,加水稀释后,促进HCO3-水解,n(OH-)增大,c(OH-)减小,由Kw不变,可知c(H+)增大,则n(H+)增大,则n(H+)与n(OH-)的乘积变大,故B正确;
C.NaHCO3为强电解质,溶质的电离方程式为NaHCO3═Na++HCO3-,故C错误;
D.由电荷守恒可知,离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选A.
点评 本题考查离子浓度大小比较,题目难度中等,选项B为解答的易错点,注意稀释促进水解时浓度与物质的量的变化不同,明确电荷守恒、盐的水解原理的影响因素为解答关键.

练习册系列答案
相关题目
19.某核素${\;}_{Z}^{A}X$可形成HmX型氢化物,则 a g HmX 含有( )
| A. | $\frac{a}{A+m}(Z+m)$mol质子 | B. | $\frac{a}{A}(Z+m)$mol电子 | ||
| C. | $\frac{a}{A+m}(A-Z+m)$mol中子 | D. | $\frac{a}{A}$mmol HmX |
14.某温度下,2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)?3Z(g)平衡时X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中又加入1molZ(g),再达平衡后,X、Y、Z的体积分数不变.下列不正确的是( )
| A. | m=2 | |
| B. | 第二次平衡时,Z的浓度为0.2mol•L-1 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 又加入1molZ,平衡没有发生移动 |
1.用电解的方法可除去溶液中的NO3-,其原理如图所示,下列说法中正确的是( )
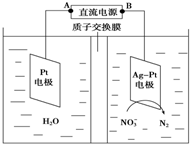

| A. | 铅蓄电池的B极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池工作过程中负极质量增加 | |
| C. | 该电解池的阳极反应为:2 NO3-+6H2O-10e-═N2↑+12OH- | |
| D. | 若电解过程中转移10mol电子,则生成N2的体积为22.4L |
18.下列反应中,还原剂与氧化剂的质量比和物质的量之比不相同的是( )
| A. | 常温下用NaOH溶液吸收Cl2 | B. | Na在空气中燃烧 | ||
| C. | Na2O2吸收CO2 | D. | S在空气中燃烧 |