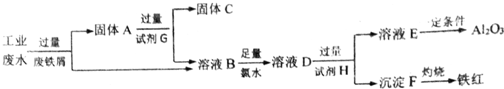
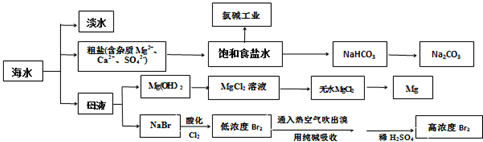
题目内容
10.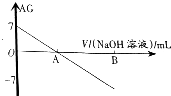 若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )
若用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].室温下实验室中用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1的醋酸,滴定过程如图所示,下列叙述正确的是( )| A. | 室温下,醋酸的电离常数约为10-5 | |
| B. | A点时加入氢氧化钠溶液的体积为20.00mL | |
| C. | 若B点为40mL,所得溶液中:c(H+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 反应过程中一定存在:0.01mol•L-1+c(OH-)=c(Na+)+c(CH3COOH) |
分析 A.室温下,醋酸的AG=lg[$\frac{C({H}^{+})}{C(O{H}^{-})}$]=7,结合水的离子积K=c(H+)•c(OH-)来计算;
B.A点的AG=lg[$\frac{C({H}^{+})}{C(O{H}^{-})}$]=0;
C.根据当B点加入NaOH溶液为40mL时,所得的为等浓度的CH3COONa和NaOH的混合溶液,然后根据电荷守恒和物料守恒来分析;
D.反应过程中根据电荷守恒一定存在:c(OH-)+c(CH3COO-)=c(Na+)+c(H+).
解答 解:A、室温下,醋酸的AG=lg[$\frac{C({H}^{+})}{C(O{H}^{-})}$]=7,即$\frac{C({H}^{+})}{C(O{H}^{-})}$=107,而水的离子积K=c(H+)•c(OH-)=10-14,两式联立可知:c(H+)=10-3.5,而在醋酸溶液中,c(CH3COO-)≈c(H+)=10-3.5,故电离平衡常数K=$\frac{C(C{H}_{3}CO{O}^{-})•C({H}^{+})}{C(C{H}_{3}COOH)}$=$\frac{1{0}^{-.35}×1{0}^{-3.5}}{0.01}$=10-5,故A正确;
B、A点的AG=lg[$\frac{C({H}^{+})}{C(O{H}^{-})}$]=0,即$\frac{C({H}^{+})}{C(O{H}^{-})}$=1,即c(H+)=c(OH-),溶液显中性,而当加入氢氧化钠溶液20mL时,恰好和醋酸完全中和,得到醋酸钠溶液,溶液显碱性,故B错误;
C、当B点加入NaOH溶液为40mL时,所得的为等浓度的CH3COONa和NaOH的混合溶液,根据电荷守恒和物料守恒可知:c(OH-)+c(CH3COO-)=c(Na+)+c(H+),c(Na+)=2[c(CH3COO-)+c(CH3COOH)],两式联立可得:c(OH-)=c(CH3COO-)+c(H+)+2c(CH3COOH),故C错误;
D、反应过程中根据电荷守恒一定存在:c(OH-)+c(CH3COO-)=c(Na+)+c(H+),但由于两溶液混合后溶液体积发生改变,故c(CH3COOH)+c(CH3COO-)<0.01mol/L,故0.01mol•L-1+c(OH-)>c(Na+)+c(H+)+c(CH3COOH),0.01mol•L-1+c(OH-)=c(Na+)+c(CH3COOH)不成立,故D错误;
故选A.
点评 本题考查了酸碱中和滴定的过程中平衡常数的计算以及三个守恒的运用,题目难度中等,注意离子浓度随着溶液体积的改变而发生的变化.

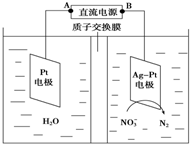
| A. | 铅蓄电池的B极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池工作过程中负极质量增加 | |
| C. | 该电解池的阳极反应为:2 NO3-+6H2O-10e-═N2↑+12OH- | |
| D. | 若电解过程中转移10mol电子,则生成N2的体积为22.4L |
| A. | 常温下用NaOH溶液吸收Cl2 | B. | Na在空气中燃烧 | ||
| C. | Na2O2吸收CO2 | D. | S在空气中燃烧 |
 向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )
向100mL未知浓度的AlCl3和MgCl2的混合溶液中逐滴加入0.1 mol•L-1的NaOH溶液,生成沉淀的质量随加入NaOH溶液体积的变化关系如图所示,则AlCl3的浓度为( )| A. | 0.005 mol•L-1 | B. | 0.01 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.1 mol•L-1 |
| A. | 氧化还原反应中,所有元素的化合价都发生变化 | |
| B. | 氧化还原反应前后一定存在氧的得失 | |
| C. | 置换反应一定属于氧化还原反应 | |
| D. | 化合反应和分解反应不可能是氧化还原反应 |
| A. | 过氧化钠与水反应时,生成0.1mol氧气,转移电子数为0.2NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中,含有的H+离子数为2NA | |
| C. | 常温常压下,1mol氦气含有的原子数为2NA | |
| D. | 标准状况下,11.2L水含有的分子数为0.5NA |
 常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )
常温下,取适量的碳酸钠溶液,向其中逐滴滴加盐酸,生成的CO2的物质的量与滴加盐酸的体积关系如图所示,其中b=2a.下列说法正确的是( )| A. | 点o溶液、点b溶液、点d溶液的pH都大于7 | |
| B. | 点b溶液中:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-)+c(Cl-) | |
| C. | 点o溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3) | |
| D. | 点a溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(Cl-)>c(OH-)>c(H+) |