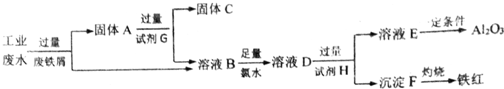
题目内容
8.将一定质量的Mg、Fe、Al混合物与足量稀H2SO4反应,生成H211.2L(标准状况),原混合物的质量可能是( )| A. | 35.7g | B. | 30g | C. | 17g | D. | 9g |
分析 用极端假设法进行分析,电子摩尔质量分别为:Mg为12g/mol,Fe为28g/mol,Al为9g/mol,假设混合物全部是Fe或全部是铝,根据生成氢气分别计算出它们的质量,混合物的质量介于最大值和最小值之间的值,据此判断.
解答 解:标况下,11.2L氢气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
所以金属提供电子的物质的量为:0.5mol×2=1mol,混合物的质量介于9g~28g之间,
故选:C.
点评 本题考查混合物的有关计算,难度中等,解答本题关键是用极端假设法考虑问题的思路,“极端假设法”是用数学方法解决化学问题的常用方法,可分别假设原混合物是某一纯净物,计算出各自的质量,混合物的质量介于最大值和最小值之间.

练习册系列答案
相关题目
18.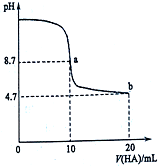 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法不正确的是( )| A. | 在逐滴加入HA溶液至20mL时,NaOH溶液中水的电离程度先增大后减小 | |
| B. | b点所示溶液中c(A-)>c(HA) | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | 该酸是弱酸 |
19.某核素${\;}_{Z}^{A}X$可形成HmX型氢化物,则 a g HmX 含有( )
| A. | $\frac{a}{A+m}(Z+m)$mol质子 | B. | $\frac{a}{A}(Z+m)$mol电子 | ||
| C. | $\frac{a}{A+m}(A-Z+m)$mol中子 | D. | $\frac{a}{A}$mmol HmX |
16.在某些工厂中常用高压电对气溶胶作用来除去大量的烟尘.以减少污染,这种做法所应用的原理是( )
| A. | 电泳 | B. | 胶体的聚沉 | C. | 布朗运动 | D. | 电解 |
3.在一定条件下,下列选项中括号内的物质能被完全消耗的是( )
| A. | 常温下将64g铜片投人过量浓硫酸中(铜片) | |
| B. | 向含有0.2molBa(OH)2和O.lmolNaOH的混合溶液中通人标况下3.36LCO2(CO2) | |
| C. | 向lOmL3mol•L-1的盐酸中加人5.6g铁(铁) | |
| D. | 向5.5gMn02粉末中加人20mL2mol•L-1双氧水(Mn02) |
18.下列反应中,还原剂与氧化剂的质量比和物质的量之比不相同的是( )
| A. | 常温下用NaOH溶液吸收Cl2 | B. | Na在空气中燃烧 | ||
| C. | Na2O2吸收CO2 | D. | S在空气中燃烧 |