题目内容
14.随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止副食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质.下列不属于抗氧化物质的是( )| A. | 生石灰 | B. | 亚硫酸钠(Na2SO3) | C. | 铁粉 | D. | 硫酸亚铁(FeSO4) |
分析 防止食品氧化变质,延长食品的保质期,在包装袋中常加入抗氧化物质,该物质应具有较强还原性,不属于抗氧化物质即不具有较强还原性,以此来解答.
解答 解:A.生石灰具有吸水性,常用作干燥剂,不具有较强还原性,不能防止食物被氧化,故A选;
B.亚硫酸钠具有较强还原性,在反应中S元素的化合价升高,能防止食物被氧化,故B不选;
C.铁粉具有较强还原性,在反应中Fe元素的化合价升高,能防止食物被氧化,故C不选;
D.硫酸亚铁(FeSO4)具有较强还原性,在反应中Fe元素的化合价升高,能防止食物被氧化,故D不选;
故选A.
点评 本题考查氧化还原反应,明确信息及元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.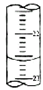 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应注视锥形瓶内容液颜色变化;
(3)该小组在步骤①中的错误是锥形瓶不能用待测液润洗,由此造成的测定结果偏高(填偏高、偏低或无影响);
(4)步骤②缺少的操作是用标准液润洗滴定管;
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
(6)根据下列数据:
请计算待测烧碱溶液的浓度为0.08 mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应注视锥形瓶内容液颜色变化;
(3)该小组在步骤①中的错误是锥形瓶不能用待测液润洗,由此造成的测定结果偏高(填偏高、偏低或无影响);
(4)步骤②缺少的操作是用标准液润洗滴定管;
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
(6)根据下列数据:
| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
2.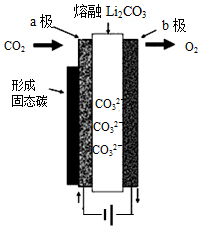 2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
 2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )| A. | 化学能转变为电能 | |
| B. | 阴极的电极反应为:CO2+4e-=C↓+2O2- | |
| C. | 阳极的电极反应为:2CO32--4e-=2CO2↑+O2↑ | |
| D. | 阴极上每通过4mole-,阴极区有1molCO2参与反应 |
9.在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是( )
| A. | AB2 | B. | A2B | C. | AB3 | D. | A3B |
19.易形成简单阴离子的元素是( )
| A. | O | B. | Mg | C. | Na | D. | He |
6.向下列溶液中逐滴加入NaOH溶液至过量,先有白色沉淀生成,然后沉淀又消失的是( )
| A. | CuCl2溶液 | B. | AlCl3溶液 | C. | MgCl2溶液 | D. | BaCl2溶液 |
3.下列说法中,正确的是( )
| A. | 钠和氢气分别在氯气中燃烧,都产生白色烟雾 | |
| B. | 铜丝在氯气中燃烧,生成蓝色的氯化铜 | |
| C. | 液氯和氯水中滴入硝酸银溶液均会产生白色沉淀 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液后溶液呈红色 |
9.工业上利用废铜屑制备胆矾的工业流程如下:
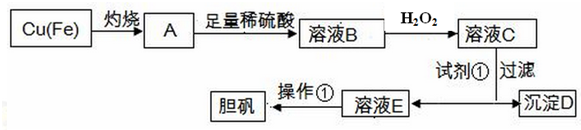
已知:
请回答:
(1)加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)检验溶液B中Fe3+的方法是向溶液中加入KSCN溶液,然后观察现象,若溶液变红色,说明溶液中存在Fe3+,否则没有铁离子.
(3)利用试剂①调节溶液的pH至3.7-5.2,试剂①的化学式CuO或Cu(OH)2或Cu2(OH)2CO3.
(4)常温下,若溶液C中金属离子均为1mol•L-1,Ksp[Fe(OH)3]=4.0×10-36,Ksp[Cu(OH)2]=2.2×10-20.控制pH=4,溶液中c(Fe3+)=4.0×10-8,此时无Cu(OH)2沉淀生成(填“有”或“无”).
(5)操作①为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(6)测定溶液E中Cu2+浓度的方法为:准确量取V1 mL溶液E于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/LNa2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL.
已知:2Cu2++4I-=2CuI↓+I22S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为蓝色变为无色.
②Cu2+的物质的量浓度为$\frac{c{V}_{2}}{{V}_{1}}$mol/L(用V1、V2、c表示).

已知:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
(1)加入H2O2时发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)检验溶液B中Fe3+的方法是向溶液中加入KSCN溶液,然后观察现象,若溶液变红色,说明溶液中存在Fe3+,否则没有铁离子.
(3)利用试剂①调节溶液的pH至3.7-5.2,试剂①的化学式CuO或Cu(OH)2或Cu2(OH)2CO3.
(4)常温下,若溶液C中金属离子均为1mol•L-1,Ksp[Fe(OH)3]=4.0×10-36,Ksp[Cu(OH)2]=2.2×10-20.控制pH=4,溶液中c(Fe3+)=4.0×10-8,此时无Cu(OH)2沉淀生成(填“有”或“无”).
(5)操作①为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(6)测定溶液E中Cu2+浓度的方法为:准确量取V1 mL溶液E于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/LNa2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL.
已知:2Cu2++4I-=2CuI↓+I22S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为蓝色变为无色.
②Cu2+的物质的量浓度为$\frac{c{V}_{2}}{{V}_{1}}$mol/L(用V1、V2、c表示).