题目内容
13.下列说法中正确的是( )| A. | 1mol O的质量是16g•mol-1 | B. | 1mol CO2的质量是44 g•mol-1 | ||
| C. | 氢的摩尔质量是2 g•mol-1 | D. | Na+的摩尔质量是23 g•mol-1 |
分析 A.质量的单位为g,g/mol为摩尔质量的单位;
B.g/mol为摩尔质量的单位;
C.没有指明是氢气还是氢原子;
D.钠离子和钠原子的摩尔质量相同,都是23g/mol.
解答 解:A.1mol O的质量是:16g/mol×1mol=16g,故A错误;
B.1mol CO2的质量是44 g•mol-1×1mol=44g,故B错误;
C.没有指明“氢”是氢原子还是氢气,故C错误;
D.电子的质量较小,则钠原子与钠离子的摩尔质量相同,都是23 g•mol-1,故D正确;
故选D.
点评 本题考查了物质的量的简单计算,题目难度不大,明确质量与摩尔质量之间的关系为解答关键,C为易错点,注意使用物质的量时必须指明粒子具体的存在形式,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
10.下列物质发生变化时,所克服的粒子间相互作用属于分子间作用力的是( )
| A. | 酒精受热变为气体 | B. | 氯化铵受热变为气体 | ||
| C. | 二氧化硅受热熔化 | D. | 食盐溶解在水中 |
4.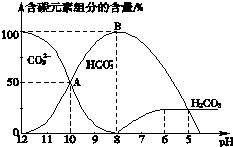 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在碱式滴定管中.若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
则c(HCl)=0.85mol•L-1.
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度偏高,若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,则实验误差为偏高(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
①请写出AB段反应的离子方程式CO32-+H+=HCO3-
②当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
 (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在碱式滴定管中.若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度偏高,若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,则实验误差为偏高(以上两空填“偏高”、“偏低”或“无影响”)
(4)常温下向20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
①请写出AB段反应的离子方程式CO32-+H+=HCO3-
②当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
1.下列离子在给定的条件下一定能大量共存的是( )
| A. | C(Fe3+)=0.1mol/L的溶液中:NH4+、I-、SO42-、Cl- | |
| B. | 加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- | |
| C. | 0.1 mol•L-1AgNO3溶液:H+、K+、SO42-、Br- | |
| D. | pH=12的溶液中:K+、Cl-、CH3COO-、CO32- |
18.下列根据反应原理设计的应用,不正确的是( )
| A. | CO32-+H2O?HCO3-+OH-:用热的纯碱溶液清洗油污 | |
| B. | A13++3H2O?AI(OH)3(胶体)+3H+:明矾净水 | |
| C. | SnCl2+H2O?Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| D. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+3H+:制备TiO2纳米粉 |
5.某元素的M层有4个P电子,下列叙述错误的是( )
| A. | N层不含电子 | B. | 该元素是硫元素 | ||
| C. | L层一定有8个电子 | D. | 原子最外层电子数为4 |
2.下列分子均属于极性分子且中心原子均为sp3杂化的是( )
| A. | CH4、P4 | B. | SO2、CHCl3 | C. | PCl3、SO3 | D. | NH3、H2O |
9.氨基甲酸铵(NH2COONH4)是一种用途广泛的化工原料,其制备原理为:2NH3(g)+C02(g)?NH2C00NH4(s).实验室可用如图1所示装置制备: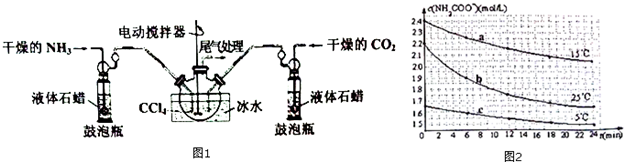
请回答下列问题:
(1)制备NH2COONH4的反应在一定条件下能自发进行,该反应的△H<0(填“>”“=”或“<”);要提高NH2COONH4的产率可采取的措施为增大压强、适当降低温度.
(2)装置中盛液体石蜡的鼓泡瓶作用是通过观察气泡,使气体流速均匀,调节NH3与CO2通入比例.
(3)一定条件下,在恒容密闭容器中通入体积比为2:1的NH3和CO2制备NH2COONH4固体.
①下列能说明反应达到平衡状态的是bd.
a、NH3和CO2物质的量之比为2:1
b.密闭容器中混合气体的密度不变
c、反应的焓变不变
d.固体的质量不在发生变化
②实验测得不同温度下达到平衡时气体的总浓度如表
30.0℃时该反应平衡常数K的计算式为$\frac{1}{(\frac{2}{3}×4.8×1{0}^{-3})^{2}×(\frac{1}{3}×4.8×1{0}^{-3})}$(不必计算结果)
(4)己知:NH2C00NH4+2H20?NH4HCO3+NH3•H2O.分别用三份不份不同初始浓度的NH2COONH4溶液测定不同温度下的水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.
①15℃时,0~6min内NH2COONH4水解反应的平均速率为0.05mol/(L•min).
②对比图中曲线a、b、c可知,水解反应速率最大的是b.

请回答下列问题:
(1)制备NH2COONH4的反应在一定条件下能自发进行,该反应的△H<0(填“>”“=”或“<”);要提高NH2COONH4的产率可采取的措施为增大压强、适当降低温度.
(2)装置中盛液体石蜡的鼓泡瓶作用是通过观察气泡,使气体流速均匀,调节NH3与CO2通入比例.
(3)一定条件下,在恒容密闭容器中通入体积比为2:1的NH3和CO2制备NH2COONH4固体.
①下列能说明反应达到平衡状态的是bd.
a、NH3和CO2物质的量之比为2:1
b.密闭容器中混合气体的密度不变
c、反应的焓变不变
d.固体的质量不在发生变化
②实验测得不同温度下达到平衡时气体的总浓度如表
| 温度(℃) | 20.0 | 30.0 | 40.0 |
| 平衡时气体总浓度 (×10-3mol•L-1) | 3.4 | 4.8 | 6.8 |
(4)己知:NH2C00NH4+2H20?NH4HCO3+NH3•H2O.分别用三份不份不同初始浓度的NH2COONH4溶液测定不同温度下的水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.
①15℃时,0~6min内NH2COONH4水解反应的平均速率为0.05mol/(L•min).
②对比图中曲线a、b、c可知,水解反应速率最大的是b.