题目内容
4. (1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).
(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,在常用仪器中应选用1000mL的容量瓶,称量时若将法码放在左盘(1g以下用游码),则配制的溶液的物质的量浓度等于0.50mol•L-1(填“大于”、“小于”或“等于”).(2)配制完毕后,用标准Na2CO3溶液滴定未知浓度的盐酸时,Na2CO3溶液应装在碱式滴定管中.若采用上述标准Na2CO3溶液滴定,滴定时实验数据列表如下:
| 次数编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,则最后所测盐酸浓度偏高,若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,则实验误差为偏高(以上两空填“偏高”、“偏低”或“无影响”)
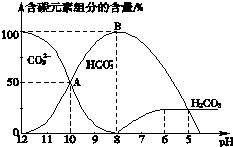
(4)常温下向20mL 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液pH逐渐降低,此时溶液中含碳元素的微粒的物质的量浓度的百分含量(纵轴)发生的变化(CO2因逸出未画出)如图所示,根据图示回答下列问题:
①请写出AB段反应的离子方程式CO32-+H+=HCO3-
②当反应到A点时,溶液中所有阳离子和阴离子的浓度大小关系为(氯离子浓度除外)c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
分析 (1)实验室配制1000mL溶液,应选用1000mL的容量瓶,根据n=cV计算碳酸钠的物质的量,再算出碳酸钠的质量,物体和砝码放反,若不使用游砝,则没有误差,若使用了游砝,物体的质量等于砝码的总质量减去游码的质量,使称得质量偏小;
(2)碳酸钠溶液呈碱性,应装在碱式滴定管中;第一次实验的数据误差较大应舍去,计算出后两次消耗碳酸钠的体积平均值,根据关系式:2HCl~Na2CO3,计算盐酸的浓度;
(3)根据c(待测)=$\frac{V(标准)c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)①OAB段碳酸氢根离子浓度增大,碳酸根离子浓度减小,说明碳酸根离子和氢离子反应生成碳酸氢根离子;
②任何电解质溶液中都存在电荷守恒,阴阳离子所带电荷总数相同.
解答 解:(1)实验室配制1000mL0.50mol•L-1的Na2CO3溶液,应选用1000mL的容量瓶,根据n=cV=0.50mol/L×1L=0.50mol,则碳酸钠的质量为:0.50 mol×106g/mol=53.0g,称量时将法码放在左盘,但未使用游码,则称得的碳酸钠的质量没有误差,所以配制的溶液的物质的量浓度等于0.50mol•L-1,
故答案为:1000;等于;
(2)碳酸钠是强碱弱酸盐,水解后呈碱性,应装在碱式滴定管中;第一次实验的数据误差较大应舍去,后两次消耗碳酸钠的体积平均值为:$\frac{16.95+17.05}{2}$mL=17.00mL,根据关系式:2HCl~Na2CO3,n(HCl)=2n(Na2CO3)=2×0.50mol/L×17.00×10-3L,c=$\frac{n(HCl)}{V(HCl)}$=$\frac{2×0.50mol/L×17.00×1{0}^{-3}L}{20.00×1{0}^{-3}L}$=0.85mol/L,
故答案为:碱;0.85;
(3)若盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,使碳酸钠的浓度变小,消耗碳酸钠的体积增多,根据c(待测)=$\frac{V(标准)c(标准)}{V(待测)}$可知最后所测盐酸浓度偏高;若原来配制所称取的Na2CO3固体中混有Na2CO3•10H2O,使标准液中溶质碳酸钠的质量减少,浓度偏低,滴定达终点时,消耗的碳酸钠的体积偏大,所测盐酸浓度偏高,
故答案为:偏高;偏高;
(4)①OAB段碳酸氢根离子浓度增大,碳酸根离子浓度减小,说明碳酸根离子和氢离子反应生成碳酸氢根离子,离子方程式为:CO32-+H+=HCO3-,
故答案为:CO32-+H+=HCO3-;
②任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),氯离子浓度除外,则有:c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-),
故答案为:c(Na+)+c(H+)>2c(CO32-)+c(HCO3-)+c(OH-).
点评 本题考查了中和滴定的应用及误差分析,要求选择掌握中和滴定的操作方法,试题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.

| A. | 氧化剂是甲醇 | |
| B. | 氧化剂与还原剂的物质的量之比为2:1 | |
| C. | 氧化产物是二氧化氯 | |
| D. | 还原产物与氧化产物的物质的量之比为6:1 |
| A. | 0.05mol•L-1 | B. | 0.30 mol•L-1 | C. | 0.15 mol•L-1 | D. | 0.5 mol•L-1 |
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4( s)溶于足量水时,放出热量为b kJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)=2H2( g)+O2( g)△H=+c kJ/mol | |
| D. | 因N2( g)+3H2( g)?2NH3( g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2 充分反应后,放出热量小于d kJ |
| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
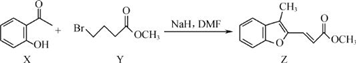
| A. | 物质 X在空气中不易被氧化 | |
| B. | 物质 Y中只含一个手性碳原子 | |
| C. | 物质 Z中所有碳原子不可能在同一平面内 | |
| D. | 等物质的量的 X、Y分别与 NaOH反应,最多消耗 NaOH的物质的量之比为 1:2 |
| A. | 1mol O的质量是16g•mol-1 | B. | 1mol CO2的质量是44 g•mol-1 | ||
| C. | 氢的摩尔质量是2 g•mol-1 | D. | Na+的摩尔质量是23 g•mol-1 |
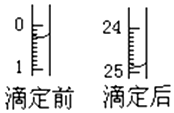 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度.