题目内容
8.已知醋酸和盐酸是日常生活中极为常见的酸.常温常压,在 pH=5的稀醋酸溶液中,c(CH3COO?)=(10-5-10-9)mol/L;下列方法中,可以使0.10mol/LCH3COOH的电离程度增大的是bdf.
a.加入少量0.10mol/L的稀盐酸b.加热CH3COOH溶液c.加入少量冰醋酸
d.加水稀释至0.010mol/L e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液.
分析 根据醋酸的电离平衡CH3COOH?H++CH3COO-和电荷守恒来计算;醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离.
解答 解:在 pH=5的稀醋酸溶液中,c(H+)=10-5mol/L,则c(OH-)=10-9mol/L,根据醋酸溶液中电荷守恒可知:c(H+)═c(OH-)+c(CH3COO-),可以看出,c(CH3COO-)=c(H+)-c(OH-)=(10-5-10-9)mol/L;
醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离,
a.加入少量0.10mol•L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故a错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故b正确;
c.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故c错误;
d.加水稀释至0.010mol•L-1,促进醋酸的电离,则醋酸的电离程度增大,故d正确;
e.加入少量氯化钠固体,不影响平衡的移动,则不改变醋酸的电离,故e错误;
f.加入少量0.10mol•L-1的NaOH溶液,氢氧根离子和氢离子反应生成水,氢离子浓度降低,促进醋酸的电离,则醋酸的电离程度增大,故f正确;
故答案为:(10-5-10-9)mol/L;bdf.
点评 本题考查了溶液中离子浓度的计算、弱电解质的电离平衡及其影响,侧重于弱电解质电离平衡应用知识的考查,题目难度中等,注意熟练掌握弱电解质的电离平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2加热时发生反应 ②Fe与过量稀H2SO4反应后,再向其中加KNO3 ③Fe与过量的S加热时发生反应 ④Fe(NO3)2溶液中加少量盐酸 ⑤Fe和Fe2O3的混合物溶于盐酸中.
①过量的Fe与Cl2加热时发生反应 ②Fe与过量稀H2SO4反应后,再向其中加KNO3 ③Fe与过量的S加热时发生反应 ④Fe(NO3)2溶液中加少量盐酸 ⑤Fe和Fe2O3的混合物溶于盐酸中.
| A. | ①③⑤ | B. | ①②④ | C. | ②④⑤ | D. | ①④⑤ |
16.合成药物异搏定路线中某一步骤如图,下列说法正确的是( )
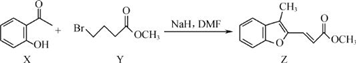

| A. | 物质 X在空气中不易被氧化 | |
| B. | 物质 Y中只含一个手性碳原子 | |
| C. | 物质 Z中所有碳原子不可能在同一平面内 | |
| D. | 等物质的量的 X、Y分别与 NaOH反应,最多消耗 NaOH的物质的量之比为 1:2 |
3.将1mol SO2和1mol O2通入密闭容器中,在一定条件下反应达到平衡,平衡体系中有SO3 0.3mol,此时若移走0.5mol O2和0.5mol SO2,则反应达到新平衡时SO3的物质的量为( )
| A. | 0.3mol | B. | 0.15mol | ||
| C. | 小于0.15mol | D. | 大于0.15mol,小于0.3mol |
13.下列说法中正确的是( )
| A. | 1mol O的质量是16g•mol-1 | B. | 1mol CO2的质量是44 g•mol-1 | ||
| C. | 氢的摩尔质量是2 g•mol-1 | D. | Na+的摩尔质量是23 g•mol-1 |
20.在标准状况下①6.72L CH4;②3.01×1023个HCl分子;③13.6g H2S;④0.2mol NH3.下列对这四种气体的关系从大到小表达不正确的是( )
| A. | 体积②>③>①>④ | B. | 密度②>④>③>① | ||
| C. | 氢原子个数②>①>③>④ | D. | 质量②>③>①>④ |
17.下列关于钠及其氧化物的叙述中正确的是( )
| A. | 钠着火后,可用泡沫灭火器来灭火 | |
| B. | 氧化钠和过氧化钠都属于碱性氧化物 | |
| C. | 过氧化钠与水的反应中,Na2O2作氧化剂,水作还原剂 | |
| D. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
4. CO2和CH4均为温室气体,研究它们具有重要的意义.
CO2和CH4均为温室气体,研究它们具有重要的意义.
(1)已知CH4、H2、CO的燃烧热△H分别为-890.3kJ/mol、-285.8kJ/mol、-283.0kJ/mol则CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.3kJ/mol.
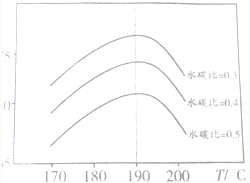
(2)以CO2和NH3为原料合成尿素是研究CO2的成功范例.在尿素合成塔中反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-86.98kJ/mol反应中影响CO2平衡转化率的因素很多,如图为特定条件下,不同水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$和温度对CO2平衡转化率的影响曲线.
①为提高CO2的转化率,生产中除控制温度外,还可采取的措施有增大压强、降低水碳比
②当温度高于190℃,CO2平衡转化率出现如图所示的变化趋势,其原因是温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低
(3)向1.0L的密闭容器中通入0.2mol NH3和0.1mol CO2,在一定的温度下,发生反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g),反应时间与气体总压强p的数据如下表:
用起始压强和总压强计算平衡时NH3 的转化率为80%,0-80min内CO2的平均反应速率是0.001mol/(L•min).
(4)氨基甲酸铵NH2COONH4极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.
 CO2和CH4均为温室气体,研究它们具有重要的意义.
CO2和CH4均为温室气体,研究它们具有重要的意义.(1)已知CH4、H2、CO的燃烧热△H分别为-890.3kJ/mol、-285.8kJ/mol、-283.0kJ/mol则CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.3kJ/mol.
(2)以CO2和NH3为原料合成尿素是研究CO2的成功范例.在尿素合成塔中反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-86.98kJ/mol反应中影响CO2平衡转化率的因素很多,如图为特定条件下,不同水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$和温度对CO2平衡转化率的影响曲线.
①为提高CO2的转化率,生产中除控制温度外,还可采取的措施有增大压强、降低水碳比
②当温度高于190℃,CO2平衡转化率出现如图所示的变化趋势,其原因是温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低
(3)向1.0L的密闭容器中通入0.2mol NH3和0.1mol CO2,在一定的温度下,发生反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g),反应时间与气体总压强p的数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 65 | 80 | 100 |
| 总压强p/100kPa | 9.53 | 7.85 | 6.37 | 5.78 | 5.24 | 4.93 | 4.67 | 4.45 | 4.45 |
(4)氨基甲酸铵NH2COONH4极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.