题目内容
1.下列离子在给定的条件下一定能大量共存的是( )| A. | C(Fe3+)=0.1mol/L的溶液中:NH4+、I-、SO42-、Cl- | |
| B. | 加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- | |
| C. | 0.1 mol•L-1AgNO3溶液:H+、K+、SO42-、Br- | |
| D. | pH=12的溶液中:K+、Cl-、CH3COO-、CO32- |
分析 A.铁离子具有氧化性,能够将碘离子氧化成碘单质;
B.加入Al粉放出H2的溶液中存在大量氢离子或氢氧根离子,铁离子与氢氧根离子反应,硝酸根离子在酸性条件下具有强氧化性,与铝反应不会生成氢气;
C.硫酸根离子、溴离子都与硝酸银反应;
D.pH=12的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.Fe3、I-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.加入Al粉放出H2的溶液呈酸性或碱性,Fe3+与氢氧根离子反应,NO3-在酸性条件下与Al反应不会生成氢气,在溶液中一定不能大量共存,故B错误;
C.AgNO3与SO42-、Br-反应生成沉淀,在溶液中不能大量共存,故C错误;
D.pH=12的溶液呈碱性,溶液中存在大量企业广告离子,K+、Cl-、CH3COO-、CO32-之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
18.下列离子方程式,正确的是( )
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 用小苏打治疗胃酸(盐酸)过多:HCO3-+H+═CO2↑+H2O | |
| D. | CaCO3溶于稀硝酸中:CO32-+2H+═CO2↑+H2O |
12.下列化学用语的相关表述正确的是( )
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4( s)溶于足量水时,放出热量为b kJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)=2H2( g)+O2( g)△H=+c kJ/mol | |
| D. | 因N2( g)+3H2( g)?2NH3( g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2 充分反应后,放出热量小于d kJ |
9.哈伯因发明了由氮气和氢气合成氨气的方法而获得了1918年的诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生N2+3H2?2NH3,下列有关说法正确的是( )
| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
16.合成药物异搏定路线中某一步骤如图,下列说法正确的是( )
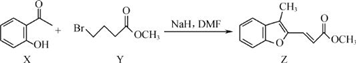

| A. | 物质 X在空气中不易被氧化 | |
| B. | 物质 Y中只含一个手性碳原子 | |
| C. | 物质 Z中所有碳原子不可能在同一平面内 | |
| D. | 等物质的量的 X、Y分别与 NaOH反应,最多消耗 NaOH的物质的量之比为 1:2 |
13.下列说法中正确的是( )
| A. | 1mol O的质量是16g•mol-1 | B. | 1mol CO2的质量是44 g•mol-1 | ||
| C. | 氢的摩尔质量是2 g•mol-1 | D. | Na+的摩尔质量是23 g•mol-1 |
11.下列反应的离子方程式中正确的是( )
| A. | Fe2(SO4)3和 Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 碳酸钡加入稀硫酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ |
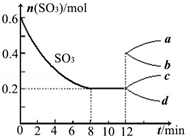 在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示: