题目内容
13.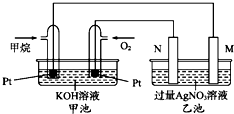 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:(1)M电极的材料是Fe,其电极名称是阴极,N的电极反应式为4OH--4e-=O2↑+2H2O,乙池的总反应是4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag↓+O2↑+4HNO3,加入甲烷的铂电极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O.
(2)在此过程中,乙池中某一电极析出金属银4.32g 时,甲池中理论上消耗氧气为0.224L(标准状况下),若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为0.1mol/L.
分析 碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,M为电解池的阴极,为铁电极,电解硝酸银溶液时,阴极反应式为Ag++e-=Ag,阳极反应式为4OH--4e-=O2↑+2H2O,结合电子的转移的物质的量的判断进行计算.
解答 解:(1)碱性甲烷燃料电池中通入甲烷的一极为原电池的负极,负极上甲烷失电子发生氧化反应,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,通入氧气的一极为原电池的正极,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,N为阳极,电极反应式是4OH--4e-=O2↑+2H2O,M为阴极,电极材料是Fe,电极反应式为Ag++e-=Ag,则乙池的总反应式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag↓+O2↑+4HNO3,
故答案为:Fe;阴极;4OH--4e-=O2↑+2H2O;4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag↓+O2↑+4HNO3;CH4-8e-+10OH-=CO32-+7H2O;
(2)n(Ag)=$\frac{4.32g}{108g/mol}$=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=$\frac{1}{4}$×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L;乙池中某一电极析出金属银4.32g时,同时产生氢离子的物质的量是0.04mol,则其浓度是0.1mol/L,
故答案为:0.224;0.1mol/L.
点评 本题考查了原电池原理和电解池原理,为高频考点,明确原电池和电解池电极上发生反应的类型即可分析解答本题,难度不大,注意电极反应式的书写与电解质溶液的酸碱性有关.

 阅读快车系列答案
阅读快车系列答案
| A. | B极中填充多孔的炭或石墨毡,目的是为了增加导电性 | |
| B. | 电池放电时,A极电极反应为:2Na++xS+2 e-=Na2SX | |
| C. | 电池放电时,Na+向电极A极移动 | |
| D. | 电池放电的总反应为2Na+xS=Na2SX,每消耗1molNa转移2mol电子 |
| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | XY |
| A. | C2H2 | B. | C3H4 | C. | C4H6 | D. | C5H8 |
| A. | b、c与a形成化合物的稳定性一定为b>c | |
| B. | a和d形成的化合物与水反应产生气体可以作燃料 | |
| C. | c,a和b可形成的化合物为离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可以为酸性、也可以为碱性 |
| A. | 2SO2+O2?2SO3 | B. | CO+H20(气)?CO2+H2 | ||
| C. | CO2+H2O?H2CO3 | D. | NaOH+HCl=NaCl+H20 |
| A | |||||||||||||||||
| D | E | I | |||||||||||||||
| B | C | F | H | G | |||||||||||||
A.C和F B.B和G C.D和G D.B和E
(2)下列由A~G形成的各分子中所有原子都满足最外层为8电子结构的是D.
A.EA3 B.AG C.FG5 D.DG4
(3)由A、E组成的一种化合物化学式为EA5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式
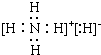 .
.(4)B,C,H,G形成的简单离子半径由大到小S2->Cl->Na+>Al3+
(5)A与I形成1:1的化合物的结构式为H-O-O-H
(6)写出B的最高价氧化物的水化物与G的最高价氧化物的水化物反应方程式:NaOH+Al(OH)3=NaAlO2+2H2O
写出HI2使酸性高锰酸钾褪色的离子方程式:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
 .
.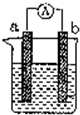 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: