题目内容
1.元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为( )| A. | XY2 | B. | X2Y3 | C. | X3Y2 | D. | XY |
分析 元素X的原子核外M电子层有3个电子,则X为Al元素,元素Y2-离子核外共有18个电子,则Y为S元素,二者化合时,Al元素为+3价、S元素表现-2价,以此解答该题.
解答 解:元素X的原子核外M电子层有3个电子,则X为Al元素;元素Y2-离子核外共有18个电子,则Y为S元素,Al、S元素最外层电子数分别是3、6,Al元素正化合价为+3价、S元素负化合价为-2价,二者化合时生成物的化学式为Al2S3,故X2Y3符合,
故选B.
点评 本题考查原子结构和元素性质,为高频考点,侧重于学生的分析能力的考查,熟悉主族元素化合价与最外层电子数的关系,题目难度不大.

练习册系列答案
相关题目
11.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA | |
| B. | 标准状况下,22.4 mL Br2所含的分子数为0.001NA | |
| C. | 标准状况下,22.4L的Cl2与1mol Fe充分反应,转移的电子数为3NA | |
| D. | 100 mL 0.1 mol•L-1的H2SO3溶液中,电离出的H+总数为0.02 NA |
12.下列实验方案能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 除去乙烷中少量乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
| B | 检验乙醇和乙酸溶液 | 分别在乙醇和乙酸中加入氢氧化钠溶液 |
| C | 制备少量氯化氢气体 | 向浓硫酸中滴加浓盐酸 |
| D | 证明Fe 3+的氧化性比Cu2+强 | 在氯化铜溶液中加入铁粉、振荡 |
| A. | A | B. | B | C. | C | D. | D |
9.短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,X原子核外M电子层的电子数为1,Y是地壳中含量最高的金属元素,Z的单质可用于自来水的杀菌消毒.根据以上叙述,下列说法中正确的是( )
| A. | 四种元素的原子半径大小为Z>Y>X>W | |
| B. | 元素W与氢形成的原子比为1:1的化合物只有2种 | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | 由Y与Z组成的化合物在熔融时能导电 |
6.Li-Al/FeS电池是一种正在开发的车载锂电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe有关该电池的下列说法中,正确的是( )
| A. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| B. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 | |
| C. | 负极的电极反应式为Al-3e-═Al3+ | |
| D. | 电解质溶液可以是氢氧化钠溶液或者稀硫酸 |
10. 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )| A. | X是HA、Z是HB | B. | Y是HA、Z是HB | C. | Z是HA、R是HB | D. | Z是HA、Y是HB |
7.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A. | 1g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4L O2含有的分子数目为NA | |
| C. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 1molZn变为Zn2+失去的电子数目为NA |
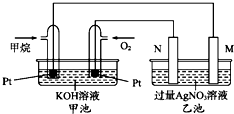 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题: