题目内容
19.现有A~I 9种短周期元素,它们在元素周期表中的位置如下.请据此回答下列问题:| A | |||||||||||||||||
| D | E | I | |||||||||||||||
| B | C | F | H | G | |||||||||||||
A.C和F B.B和G C.D和G D.B和E
(2)下列由A~G形成的各分子中所有原子都满足最外层为8电子结构的是D.
A.EA3 B.AG C.FG5 D.DG4
(3)由A、E组成的一种化合物化学式为EA5,其各原子均达到同周期稀有气体原子的稳定结构,试写出该化合物的电子式
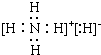 .
.(4)B,C,H,G形成的简单离子半径由大到小S2->Cl->Na+>Al3+
(5)A与I形成1:1的化合物的结构式为H-O-O-H
(6)写出B的最高价氧化物的水化物与G的最高价氧化物的水化物反应方程式:NaOH+Al(OH)3=NaAlO2+2H2O
写出HI2使酸性高锰酸钾褪色的离子方程式:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
分析 由元素在周期表中位置知:A为H,B为Na,C为Al,D为C,E为N,F为P,I为O,H为S,G为Cl.
(1)活泼的金属与活泼的非金属之间是容易形成离子键,非金属元素间一般形成共价键;
(2)在ABn型分子中,如果中心元素化合价绝对值+该元素原子最外层电子数=8,则该分子中所有原子都达到8电子稳定结构,但氢化物除外;
(3)由A、E组成的一种化合物化学式为EA5,其各原子均达到同周期稀有气体原子的稳定结构,该化合物为NH4H,属于离子化合物,由铵根离子与氢负离子构成;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大;
(5)A与I形成1:1的化合物为H2O2;
(6)B、G的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
SO2被酸性高锰酸钾氧化生成硫酸,同时还原得到Mn2+.
解答 解:由元素在周期表中位置知:A为H,B为Na,C为Al,D为C,E为N,F为P,I为O,H为S,G为Cl.
(1)活泼金属和活泼非金属元素之间易形成离子键,这几种元素中金属性最强的是Na元素、非金属性最强的是Cl,所以B和G最容易形成离子键,故选B;
(2)A.EA3为NH3,氢化物中H原子一定不能达到8电子结构,故A错误;
B.AG为HCl,氢化物中H原子一定不能达到8电子结构,故B错误;
C.PCl5分子中P元素化合价为+5价,其最外层电子数是5,5+5=10,所以该分子中并不是所有原子达到8电子结构,故C错误;
D.DG4为CCl4,C元素化合价为+4价、其最外层电子数是4,4+4=8,所以该分子中所有原子都达到8电子结构,故D正确;
故选D;
(3)由H、N组成的一种化合物化学式为NH5,其各原子均达到同周期稀有气体原子的稳定结构,该化合物化学式为NH4H,属于离子化合物,其电子式为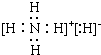 ,故答案为:
,故答案为: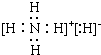 ;
;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2->Cl->Na+>Al3+,故答案为:S2->Cl->Na+>Al3+;
(5)A与I形成1:1的化合物为H2O2,结构式为H-O-O-H,故答案为:H-O-O-H;
(6)B、G的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,
SO2被酸性高锰酸钾氧化生成硫酸,同时还原得到Mn2+,反应离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,
故答案为:NaOH+Al(OH)3=NaAlO2+2H2O;5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
点评 本题考查元素周期表与元素周期律应用,熟练掌握元素周期表结构,注意对元素化合物知识掌握,理解8电子稳定结构判断.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| A. | HN03 | B. | Ba(OH)2 | C. | (NH4)2SO4 | D. | H2O |
| A. | 1g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4L O2含有的分子数目为NA | |
| C. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 1molZn变为Zn2+失去的电子数目为NA |
| A. | 3,3-二甲基-1-丁烯 | B. | 2,2-二甲基-2-丁烯 | ||
| C. | 2,2-二甲基-3-丁炔 | D. | 3,3-二甲基-1-丁炔 |
 ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )| A. | ③①④②⑥⑤ | B. | ①③⑥④②⑤ | C. | ③②①⑥④⑤ | D. | ⑤⑥②④①③ |
| A. | P4和NO2都是共价化合物 | |
| B. | CCl4和NH3都是以极性键结合的极性分子 | |
| C. | H2O2的分子是含有极性键的非极性分子 | |
| D. | 在SiC和SiO2晶体中,都不存在单个小分子 |
 通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列物质的熔点高低(填“>”或“<”):SiCl4<SiO2,原因是SiCl4为分子晶体,SiO2为原子晶体.
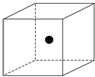
(2)图中立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g);
1mol晶体硅中含2molSi-Si键;该反应的反应热△H=+236kJ•mol-1.
| A. | 常温下,78 g 固体Na2O2中,含有的阴阳离子总数为4 NA | |
| B. | 标准状况下,4.48L HF分子中含0.2NA个H-F键 | |
| C. | 常温常压下,8gO2含有8NA个电子 | |
| D. | 4℃时,20 g 2H216O中含有共用电子对数为2 NA |
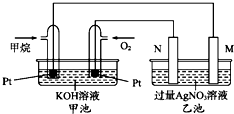 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题: