题目内容
3.A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的$\frac{2}{3}$;A能分别与B、C、D形成电子总数相等的分子X、Y、Z.回答下列问题:(1)B、D两元素的名称分别是碳、氧.
(2)化合物B2A2的电子式为
 .
.(3)Y与C的最高价氧化物的水化物刚好完全反应时,其生成物的水溶液呈酸性(填“酸”、“碱”或“中”),原因是:NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)在(3)所得生成物的水溶液中,存在如下关系,用离子浓度符号填写:
①c(H+)+c(NH4+)=c(OH-)+c(NO3-);
②c(H+)=c(OH一)+c(NH3•H2O).
(5)用X、D2、NaOH溶液和惰性电极可设计一种燃料电池,该燃料电池的
负极反应为:CH4-8e-+10OH-═CO32-+7H2O.
正极反应为:2O2+8e-+4H2O═8OH-.
分析 A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的$\frac{2}{3}$倍,结合原子序数可知,B处于第二周期,且处于偶数族,A能分别与B、C、D形成电子总数相等的分子X、Y、Z,考虑为氢化物,X为H元素,可推知B为C元素、C为N元素,D为O元素,X、Y、Z分别为CH4、NH3、H2O,验证符合题意,
(1)由上述分析可知,B为碳,D为氧,故答案为:碳;氧;
(2)化合物B2A2为C2H2,C原子之间形成三对共用电子对,C原子与H原子之间形成1对共用电子对;
(3)所得溶液为硝酸铵溶液,溶液中NH4+水解,破坏水的电离平衡溶液呈酸性;
(4)①根据溶液中电荷守恒解答;
②溶液中氢离子来源于水的电离、NH4+水解,根据质子恒等式解答;
(5)负极发生氧化反应,CH4在负极失去电子,碱性条件下生成碳酸根、H2O,正极发生还原反应氧气在正极获得电子,碱性条件下生成氢氧根离子.
解答 解:A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的$\frac{2}{3}$倍,结合原子序数可知,B处于第二周期,且处于偶数族,A能分别与B、C、D形成电子总数相等的分子X、Y、Z,考虑为氢化物,X为H元素,可推知B为C元素、C为N元素,D为O元素,X、Y、Z分别为CH4、NH3、H2O,验证符合题意,则:
(1)由上述分析可知,B为碳,D为氧,故答案为:碳;氧;
(2)化合物B2A2为C2H2,C原子之间形成三对共用电子对,C原子与H原子之间形成1对共用电子对,其电子式为: ,
,
故答案为: ;
;
(3)Y与C的最高正价氧化物的水化物刚好完全反应时,所得溶液为硝酸铵溶液,溶液中NH4+水解NH4++H2O?NH3•H2O+H+,破坏水的电离平衡溶液呈酸性,
故答案为:酸;NH4++H2O?NH3•H2O+H+;
(4)①根据溶液中电荷守恒解,可知c(H+)+c(NH4+)=c(OH-)+c(NO3-),
故答案为:c(NH4+);c(NO3-);
②溶液中氢离子来源于水的电离、NH4+水解,根据质子恒等式,可知c(H+)=c(OH-)+c(NH3•H2O),
故答案为:c(NH3•H2O);
(5)负极发生氧化反应,CH4在负极失去电子,碱性条件下生成碳酸根、H2O,负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O,
正极发生还原反应氧气在正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为;2O2+8e-+4H2O═8OH-,
故答案为:CH4-8e-+10OH-═CO32-+7H2O;2O2+8e-+4H2O═8OH-.
点评 本题考查结构性质位置关系、盐类水解、溶液离子浓度比较、热化学方程式、原电池等,题目比较综合,推断元素是解题关键,本题难点是元素的推断,需要学生熟练掌握基础知识,难度中等.

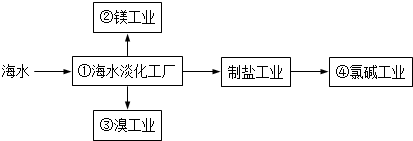
| A. | ①中可采用蒸馏法 | B. | ②中可通过电解法制金属镁 | ||
| C. | ③中提溴涉及到复分解反应 | D. | ④的产品可生产盐酸、漂白液等 |
| A. | 常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA | |
| B. | 标准状况下,22.4 mL Br2所含的分子数为0.001NA | |
| C. | 标准状况下,22.4L的Cl2与1mol Fe充分反应,转移的电子数为3NA | |
| D. | 100 mL 0.1 mol•L-1的H2SO3溶液中,电离出的H+总数为0.02 NA |
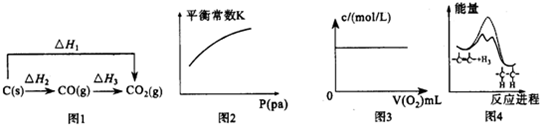 ( )
( )| A. | 图1中的△H1>△H2 | |
| B. | 对于可逆反应A(s)+3B(g)?2C(g)△H>0,压强对平衡常数K的影响符合图2 | |
| C. | 图3表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系 | |
| D. | 由图4可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
| A. | 10 g H218O与10 g D2O所含的中子数均为5NA | |
| B. | 2.4 g Mg在空气中充分燃烧,转移电子数为0.2NA | |
| C. | l L0.1 mol•L-l NH4Cl溶液中所含NH4+数为0.1NA | |
| D. | 100 g质量分数为46%的酒精水溶液中含氧原子总数为4NA |
| 选项 | 实验目的 | 实验方案 |
| A | 除去乙烷中少量乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
| B | 检验乙醇和乙酸溶液 | 分别在乙醇和乙酸中加入氢氧化钠溶液 |
| C | 制备少量氯化氢气体 | 向浓硫酸中滴加浓盐酸 |
| D | 证明Fe 3+的氧化性比Cu2+强 | 在氯化铜溶液中加入铁粉、振荡 |
| A. | A | B. | B | C. | C | D. | D |
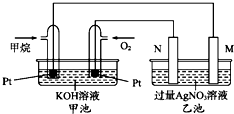 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题: