题目内容
8.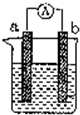 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,正极的现象为:Al-3e-=Al3+,负极的电极反应式为:产生气泡.
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置负极反应式Al-3e-+4OH-=AlO2-+2H2O.若1mol金属完全反应溶解,需要消耗NaOH溶质的质量为40g.
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能.现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入b极(填a或b),a极反应式为O2+H2O+4e-=4OH-,电子从b极流出,电解液中氢氧化钠的物质的量不变(填“增大”、“减小”或“不变”).
分析 (1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,Al易失电子作负极、Cu正极,正极上氢离子得电子发生还原反应;
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置能自发进行氧化还原反应,能构成原电池,Al作负极、Mg作正极;
(3)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:(1)Al、Cu、稀硫酸构成的原电池,金属铝做负极,发生,金属铜为正极,正极发生还原反应,电极反应为:2H++2e-=H2↑,有气泡产生,
故答案为:产生气泡;Al-3e-=Al3+;
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置能自发进行氧化还原反应,能构成原电池,Al作负极、Mg作正极,电池反应式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,负极为Al-3e-+4OH-=AlO2-+2H2O,由方程式可知,若1mol金属完全反应溶解,需要消耗NaOH1mol,质量为40g,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;40;
(3)燃料电池中,负极上燃料失电子发生氧化反应,所以通入氢气的电极为b,a极发生O2+H2O+4e-=4OH-,
正极上氧化剂得电子发生还原反应,电子从负极b沿导线流向正极a,所以电子从b电极流出,反应生成水,氢氧化钠物质的量不变,
故答案为:b;O2+H2O+4e-=4OH-;b;不变.
点评 本题考查原电池原理,为高频考点,把握图中装置的分析及原电池的工作原理为解答的关键,侧重电极、电极反应、转移电子的考查,注意(2)中不能直接利用金属活泼性判断负极,应从氧化还原反应的角度考虑,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
19.下列说法正确的是( )
| A. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| B. | 煤的气化和液化能提高煤的利用率、减少污染 | |
| C. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| D. | 煤的干馏、石油的分馏为物理变化 |
3.下列各组金属和液体(配有导线),能组成原电池的是( )
| A. | Cu、Cu、稀硫酸 | B. | C、Pt、氯化钠溶液 | C. | Cu、Zn、酒精 | D. | Fe、Cu、FeCl3溶液 |
20.下列说法正确的是( )
| A. | C4H10有3种同分异构体 | |
| B. | 正戊烷和新戊烷互为同分异构体,它们分子中所含化学键种类和数量不完全相同 | |
| C. | 丙烷的二溴代物比其三溴代物的种类少 | |
| D. | 分子式为C6H6的物质一定是苯 |
14.某炔烃与氢气加成后得到2,2-二甲基丁烷,该炔烃的名称是( )
| A. | 3,3-二甲基-1-丁烯 | B. | 2,2-二甲基-2-丁烯 | ||
| C. | 2,2-二甲基-3-丁炔 | D. | 3,3-二甲基-1-丁炔 |
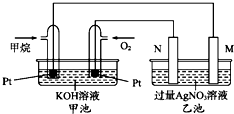 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题: