题目内容
2.下列体系加压后,对化学反应速率没有影响的是( )| A. | 2SO2+O2?2SO3 | B. | CO+H20(气)?CO2+H2 | ||
| C. | CO2+H2O?H2CO3 | D. | NaOH+HCl=NaCl+H20 |
分析 加压后,对化学反应速率没有明显影响,则反应体系中没有气体参加反应,以此来解答.
解答 解:A、B、C中的反应中均为有气体参加的反应,只有D为溶液中的中和反应,没有气体参加,则改变压强对反应速率无影响,
故选D.
点评 本题考查化学反应速率的因素,为高频考点,把握压强对反应速率的影响及反应的特点为解答的关键,注意压强只影响有气体参加的反应的反应速率,题目难度不大.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
12.下列实验方案能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 除去乙烷中少量乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
| B | 检验乙醇和乙酸溶液 | 分别在乙醇和乙酸中加入氢氧化钠溶液 |
| C | 制备少量氯化氢气体 | 向浓硫酸中滴加浓盐酸 |
| D | 证明Fe 3+的氧化性比Cu2+强 | 在氯化铜溶液中加入铁粉、振荡 |
| A. | A | B. | B | C. | C | D. | D |
10. 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
 取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )
取0.1mol•L-1的NaA和NaB两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O?HA+NaHCO3、2NaB+CO2+H2O?2HB+Na2CO3.则HA和HB的1L溶液分别加水稀释至体积为VL时对应的曲线是( )| A. | X是HA、Z是HB | B. | Y是HA、Z是HB | C. | Z是HA、R是HB | D. | Z是HA、Y是HB |
3.粗盐提纯制精盐的实验中,不需要的操作是( )
| A. | 溶解 | B. | 过滤 | C. | 洗涤 | D. | 蒸馏 |
10.既有离子键又有共价键和配位键的化合物是( )
| A. | HN03 | B. | Ba(OH)2 | C. | (NH4)2SO4 | D. | H2O |
7.用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A. | 1g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4L O2含有的分子数目为NA | |
| C. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 1molZn变为Zn2+失去的电子数目为NA |
8. 通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
(1)比较下列物质的熔点高低(填“>”或“<”):SiCl4<SiO2,原因是SiCl4为分子晶体,SiO2为原子晶体.
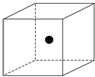
(2)图中立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g);
1mol晶体硅中含2molSi-Si键;该反应的反应热△H=+236kJ•mol-1.
 通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H).化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列物质的熔点高低(填“>”或“<”):SiCl4<SiO2,原因是SiCl4为分子晶体,SiO2为原子晶体.
(2)图中立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g);
1mol晶体硅中含2molSi-Si键;该反应的反应热△H=+236kJ•mol-1.
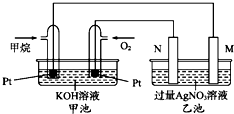 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题: