题目内容
11.将2.3g钠投入到97.8g水中,反应完毕后,得到100mL的溶液.求:(1)产生氢气在标况下的体积1.12L.
(2)所得氢氧化钠溶液的溶质质量分数4%.
(3)所得氢氧化钠溶液的物质的量浓度1mol/L.
(4)在K2Cr2O7+14HCl═2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3mol电子转移时生成Cl2的体积为3.36L(标准状况),被氧化的HCl的物质的量为0.3mol.
分析 (1)根据n=$\frac{m}{M}$计算出钠的物质的量,然后根据反应方程式计算出生成氢气的体积;
(2)根据Na元素守恒可知生成氢氧化钠的物质的量与钠的物质的量相等,根据m=nM计算出氢氧化钠的质量,然后计算出所得溶液的质量分数;
(3)根据n=$\frac{c}{V}$计算出所得氢氧化钠溶液的物质的量浓度;
(4)反应中Cr元素化合价降低,被还原,K2Cr2O7具有氧化性,Cl元素化合价由-1价升高到0价,若转移了0.3mol的电子,则生成氯气0.15mol,根据V=nVm计算;HCl被氧化生成氯气,根据Cl元素守恒及氯气的物质的量计算出被氧化的HCl的物质的量.
解答 解:(1)2.3gNa的物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,则
2Na+2H2O=2NaOH+H2↑,
2mol 22.4L
0.1mol V(H2)
生成氢气在标准状况下的体积为:V(H2)=$\frac{22.4L×0.1mol}{2mol}$=1.12L,
故答案为:1.12L;
(2)0.1molNa完全反应生成0.1molNaOH,氢氧化钠的质量为:40g/mol×0.1mol=4g,所得溶液质量为:2.3g+97.8g-2g/mol×0.05mol=100g,
所得溶液中氢氧化钠的质量分数为:$\frac{4g}{100g}$×100%=4%,
故答案为:4%;
(3)所得氢氧化钠溶液的物质的量浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,
故答案为:1mol/L;
(4)反应中Cl元素化合价由-1价升高到0价,若转移了0.3mol的电子,则生成氯气的物质的量为:$\frac{0.3mol}{2}$=0.15mol,在标准状况下的体积为:0.15mol×22.4L/mol=3.36L;
反应中HCl被氧化成氯气,根据Cl元素守恒可知被氧化的HCl的物质的量为:0.15mol×2=0.3mol,
故答案为:3.36L;0.3mol.
点评 本题考查了氧化还原反应的计算、化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握电子守恒、质量守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 标准状况下,32 g O2占有的体积约为22.4 L | |
| B. | 氢气的摩尔质量是2g | |
| C. | 在标准状况下,22.4 L水的质量为18 g | |
| D. | 1molH2O的质量是18g/mol |
| A. | 该反应不能发生,不符合复分解反应发生条件,无沉淀或气体或水,应该左右倒过来写 | |
| B. | 该反应是复分解反应,能发生的原因可能是碳酸酸性比HClO强,符合强酸制弱酸原理 | |
| C. | 该反应不是复分解反应是氧化还原反应,自然不能套用复分解反应条件或规律 | |
| D. | 该反应可能是NaHCO3难溶于水,正好符合复分解反应发生条件之一 |
| A. | 1mol Al3+离子含有的核外电子数为3NA | |
| B. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| C. | 10 LpH=l的硫酸溶液中含有的H+离子数为NA | |
| D. | 1L0.5mol/L的碳酸钠溶液中含有的CO32-离子数为0.5NA |
| A. | 1:2 | B. | 2:1 | C. | 4:1 | D. | l:l |
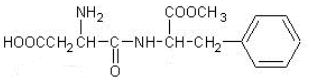
下列关于阿斯巴甜的说法正确的是( )
| A. | 分子式为C14H19N2O5 | B. | 既能与酸反应又能与碱反应 | ||
| C. | 不能发生水解反应 | D. | 1mol该物质最多可与2molNaOH反应 |
| A. | 由乙烯制取氯乙烷 | B. | 乙烷在空气中燃烧 | ||
| C. | 乙烷在光照下与氯气反应 | D. | 乙烯使酸性高锰酸钾溶液褪色 |
| A. | H2CO3?2H++CO32- | B. | Ca(OH)2?Ca2++2OH- | ||
| C. | Fe2(SO4)3?2Fe2++3SO42- | D. | NaHCO3?Na++HCO3- |