题目内容
1.下列说法中正确的是( )| A. | 标准状况下,32 g O2占有的体积约为22.4 L | |
| B. | 氢气的摩尔质量是2g | |
| C. | 在标准状况下,22.4 L水的质量为18 g | |
| D. | 1molH2O的质量是18g/mol |
分析 A.根据n=$\frac{m}{M}$、V=nVm计算出标准状况下氧气的体积;
B.摩尔质量的单位为g/mol;
C.标准状况下水的状态不是气体;
D.质量的单位为g,不是g/mol.
解答 解:A.32g氧气的物质的量为:$\frac{32g}{32g/mol}$=1mol,标准状况下1mol氧气的体积约为:22.4L/mol×1mol=22.4L,故A正确;
B.氢气的摩尔质量为2g/mol,故B错误;
C.标准状况下,水不是气态,不能使用标准状况下的气体摩尔体积计算,故C错误;
D.1mol水的质量为:18g/mol×1mol=18g,故D错误;
故选A.
点评 本题考查了物质的量的计算与判断,题目难度不大,明确物质的量与质量的关系为解答关键,注意掌握标准状况下气体摩尔体积的使用条件,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
15.“生物质能”主要是指树木、庄稼、草类等植物直接或间接提供的能量;古老的柴火做饭、烧炭取暖等粗放用能方式正被现代科学技术所改变,下面说法错误的是( )
| A. | 生物质能的缺点是严重污染环境 | |
| B. | 生物质能源是可再生的能源 | |
| C. | 利用生物质能就是间接利用太阳能 | |
| D. | 使用沼气这种生物质能是对化学能的充分利用 |
12.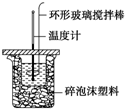 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1.为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=-51.8kJ•mol-1(结果保留一位小数).
(3)不能(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热.
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1.为了计算中和热,某学生实验记录数据如下:
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(3)不能(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热.
16. 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为c<a<b
(2)a、b、c三点处,电离程度最大的是c
(3)表是几种常见弱酸的电离平衡常数(25℃):
CH3COOH、H2CO3、HClO,其中酸性最强的是CH3COOH,最弱的是HClO
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4H2SO4═2H++SO42-
②NH3•H2ONH3•H2O?NH4++OH-.
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为c<a<b
(2)a、b、c三点处,电离程度最大的是c
(3)表是几种常见弱酸的电离平衡常数(25℃):
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H | K=1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-H2CO3-?H++HCO32- | K1=4.31×10-7K2=5.61×10-11 |
| HClO | HClO?H++ClO- | K=3.0×10-8 |
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4H2SO4═2H++SO42-
②NH3•H2ONH3•H2O?NH4++OH-.
6.下列实验现象描述不正确的是( )
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小钠块 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在含有酚酞的水中加入一小块钠 | 钠浮在水面上,四处游动,发出嘶嘶响声,溶液变红 |
| D | 在空气中久置的铝条放入稀硫酸溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
13.有下列几种方法制备O2:(1)KClO3和MnO2共热,(2)H2O2中加MnO2,(3)KMnO4受热分解,若要制相同质量的O2,则上述反应中相关物质转移的电子数之比为( )
| A. | 3:2:4 | B. | 1:1:1 | C. | 2:1:2 | D. | 1:2:1 |