题目内容
2.关于NaClO+CO2+H2O=NaHCO3+HClO 之所以能发生解释正解的是( )| A. | 该反应不能发生,不符合复分解反应发生条件,无沉淀或气体或水,应该左右倒过来写 | |
| B. | 该反应是复分解反应,能发生的原因可能是碳酸酸性比HClO强,符合强酸制弱酸原理 | |
| C. | 该反应不是复分解反应是氧化还原反应,自然不能套用复分解反应条件或规律 | |
| D. | 该反应可能是NaHCO3难溶于水,正好符合复分解反应发生条件之一 |
分析 NaClO+CO2+H2O=NaHCO3+HClO为强酸制取弱酸的反应,可知碳酸的酸性大于HClO的酸性,以此来解答.
解答 解:NaClO+CO2+H2O=NaHCO3+HClO之所以能发生,该反应是复分解反应,能发生的原因可能是碳酸酸性比HClO强,符合强酸制弱酸原理,与A、C、D无关,
故选B.
点评 本题考查复分解反应,为高频考点,把握反应的特点及强酸制取弱酸的规律为解答的关键,侧重分析与应用能力的考查,注意特殊的复分解反应,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
12.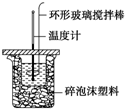 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1.为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=-51.8kJ•mol-1(结果保留一位小数).
(3)不能(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热.
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1.为了计算中和热,某学生实验记录数据如下:
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(3)不能(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热.
13.有下列几种方法制备O2:(1)KClO3和MnO2共热,(2)H2O2中加MnO2,(3)KMnO4受热分解,若要制相同质量的O2,则上述反应中相关物质转移的电子数之比为( )
| A. | 3:2:4 | B. | 1:1:1 | C. | 2:1:2 | D. | 1:2:1 |
17.下列关于常见化学物质的应用不正确的是( )
| A. | 干冰能用作冷冻剂 | |
| B. | 明矾可用作净水剂 | |
| C. | 味精可用作食品调味剂 | |
| D. | 苏打是一种膨松剂,可用于制作馒头和面包 |
14.常温下将pH=9的Ba(OH)2溶液稀释500倍,稀释溶液后,c (OH-)与c (Ba2+)的比值近似为( )
| A. | 1:1 | B. | 1:2 | C. | 10:1 | D. | 2:1 |
12.下列有关说法正确的是( )
| A. | 0.1L物质的量浓度为2mol/L的(NH4)2S溶液中含有的S2-数目为0.2×6.02×1023 | |
| B. | 对NaCl溶液和金属钠加热,都会使导电能力增强 | |
| C. | 25℃时,向0.1mol/LCH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 | |
| D. | 用惰性电极电解1L 1mol/L的CuSO4溶液,当阴极析出3.2g铜时,加入0.05mol Cu(OH)2固体可将溶液浓度恢复至元浓度 |