题目内容
9.下列属于非电解质的是( )| A. | 葡萄糖 | B. | 氢氧化钠 | C. | 氯化钾 | D. | 铁 |
分析 在水溶液里或熔融状态下都不导电的化合物是非电解质,在水溶液里或熔融状态下能导电的化合物是电解质.
解答 解:A、葡萄糖在水溶液里或熔融状态下以分子存在导致不导电,所以葡萄糖是非电解质,故A正确;
B、氢氧化钠是化合物,水溶液中或熔融状态下电离出离子导电,故氢氧化钠是电解质,故B错误;
C、氯化钾是化合物,水溶液中或熔融状态下电离出离子导电,所以氯化钾是电解质,故C错误;
D、金属铁是单质不是化合物,所以既不是电解质也不是非电解质,故D错误;
故选A.
点评 本题考查了电解质和非电解质的判断,难度不大,注意无论电解质还是非电解质都必须是化合物.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
19.设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 标准状况下,VL水含有的氧原子个数约为V/22.4 NA | |
| B. | 常温常压下,1 mol 碳烯( CH2)所含的电子总数为8NA | |
| C. | 标准状况下,含NA个氩原子的氩气体积约为22.4L | |
| D. | 1mol OH-参与电解,提供的电子数目为NA个 |
4.四丁基氢氧化铵[(C4H9)4NOH]常作电子工业清洗剂.以四丁基溴化铵[(C4H9)4NBr]为原料,采用电渗析法合成(C4H9)4NOH,原理如图(c、d、e为离子交换膜).下列说法不正确的是( )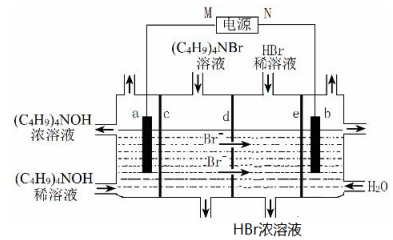

| A. | M为负极 | |
| B. | b极电极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c、e分别为阳离子交换膜和阴离子交换膜 | |
| D. | 制备 1mol(C4H9)4NOH,理论上 a极产生11.2L气体(标准状况下) |
14.已知:X(g)+2Y(g)?3Z(g)△H=-a KJ•mol-1(a>0).下列说法不正确的是( )
| A. | 0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol | |
| B. | 达到化学平衡状态时,X、Y、Z的浓度不再发生变化 | |
| C. | 达到化学平衡状态时,反应放出的总热量可达a kJ | |
| D. | 升高反应温度,逆反应速率增大,正反应速率减小 |
1.对水样中溶质M的分解速率影响因素进行研究.在相同温度下,M的物质的量浓度(mol•L-1)随时间(min)变化的有关实验数据见表.下列说法不正确的是( )
| 时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
| Ⅰ(pH=2) | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
| Ⅱ(pH=4) | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
| Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
| Ⅳ(pH=4,含Ca2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
| A. | 在0~20 min内,Ⅰ中M的分解速率为0.015 mol•L-1•min-1 | |
| B. | 水样酸性越强,M的分解速率越快 | |
| C. | 在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大 | |
| D. | 由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快 |
11.通过观察化学实验现象,分析归纳出正确的结论,是学习化学科学最基本的技能之一.下列由实验现象得出结论正确的是( )
| A. | 把相同大小的Al和Mg分别投入相同浓度的NaOH溶液中:Al溶解有气泡放出,而Mg没有任何变化.由此得出:Al的金属性比镁强 | |
| B. | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落.由此得出:铝不能燃烧 | |
| C. | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡.由此得出:该气体一定是氨气 | |
| D. | 向AlCl3溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失.由此得出:Al(OH)3能溶于强碱溶液 |

 .
.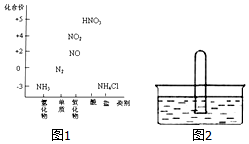 图1为氮及其化合物的类别与化合价对应的关系图.
图1为氮及其化合物的类别与化合价对应的关系图.