题目内容
19.设NA表示阿伏加德罗常数,下列叙述中不正确的是( )| A. | 标准状况下,VL水含有的氧原子个数约为V/22.4 NA | |
| B. | 常温常压下,1 mol 碳烯( CH2)所含的电子总数为8NA | |
| C. | 标准状况下,含NA个氩原子的氩气体积约为22.4L | |
| D. | 1mol OH-参与电解,提供的电子数目为NA个 |
分析 A、标况下水为液体;
B、1个碳烯(:CH2)含有8个电子;
C.氩是单原子分子;
D.电极反应式:4OH--4e-=2H2O+O2↑.
解答 解:A.标准状况下,水不是气体,无法计算其物质的量,故A错误;
B.1个碳烯(:CH2)含有8个电子,1mol碳烯(:CH2)所含的电子总数为8NA,故B正确;
C.氩是单原子分子,NA个氩原子的物质的量是1mol,标况下约为22.4 L,故C正确;
D.电极反应式:4OH--4e-=2H2O+O2↑,1 mol OH-参与电解,反应过程中转移的电子数为NA,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
20.下列说法正确的是( )
| A. | 纳米铁粉可以高效地去除被污染水体中的 Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 | |
| B. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 火力发电中,燃烧是使化学能转换为电能的关键 |
7. 合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该可逆反应达到平衡的标志是C;
A.3v(H2)正=2v(NH3)逆
B.单位时间生成mmolN2的同时生成3mmolH2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)氨气具有还原性,例如,氨气能与卤素单质发生置换反应.已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸汽反应的热化学方程式2NH3 (g)+3Br2(g)=N2(g)+6HBr(g)△H=-214KJ/mol;
(3)工业上可用天然气为原料来制取合成氨的原料气氢气.某研究性学习小组的同学模拟工业制取氨气的原理,在一定温度下,体积为2L的恒容密闭容器中,测得如下表所示数据.请回答下列问题:
①分析标准数据,判断5min时反应是否处于平衡状态(填“是”或“否”),前5min反应的平均反应速率v(CH4)=0.02mol•min-1;
②该温度下,上述反应的平衡常数K=0.0675;
③反应在7-10min内,CO的物质的量减少的原因可能是D(填字母)
A.减少CH4的物质的量 B.降低温度 C.升高温度 D.充入H2
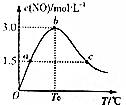
(4)氨的催化氧化:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)是工业制硝酸的重要反应.在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示.该反应的△H<0(填“>”、“<”
或“=”);T0温度下,NH3的转化率为75%.
 合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3.该可逆反应达到平衡的标志是C;
A.3v(H2)正=2v(NH3)逆
B.单位时间生成mmolN2的同时生成3mmolH2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)氨气具有还原性,例如,氨气能与卤素单质发生置换反应.已知几种化学键的键能数据如表所示:
请写出氨气与溴蒸汽反应的热化学方程式2NH3 (g)+3Br2(g)=N2(g)+6HBr(g)△H=-214KJ/mol;
| 化学键 | N-H | N≡N | Br-Br | H-Br |
| 键能/kJ•mol-1 | 391 | 946 | 194 | 366 |
| 时间/min | CH4(mol) | H2O(mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
②该温度下,上述反应的平衡常数K=0.0675;
③反应在7-10min内,CO的物质的量减少的原因可能是D(填字母)
A.减少CH4的物质的量 B.降低温度 C.升高温度 D.充入H2
(4)氨的催化氧化:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)是工业制硝酸的重要反应.在1L密闭容器中充入4molNH3(g)和5molO2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示.该反应的△H<0(填“>”、“<”
或“=”);T0温度下,NH3的转化率为75%.
14.将一质量分数为ω的KOH溶液蒸发掉m g水后,质量分数恰好变为2ω,体积为V(溶液中无晶体析出),则浓缩后溶液的物质的量浓度为( )
| A. | $\frac{mω}{28V}$mol•L-1 | B. | $\frac{mω}{56V}$ mol•L-1 | C. | $\frac{mω}{112V}$mol•L-1 | D. | $\frac{mω}{V}$ mol•L-1 |
9.下列属于非电解质的是( )
| A. | 葡萄糖 | B. | 氢氧化钠 | C. | 氯化钾 | D. | 铁 |
 .
.