题目内容
10.如图是某企业设计的硫酸-磷肥-水泥联产、海水-淡水多用、盐-热-电联产的三大生态产业链流程图.
根据上述产业流程回答下列问题:
(1)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出③、④输送的主要物质的化学式或能量形式:③热能 ④SO2.
(2)沸腾炉发生反应的化学方程式:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.磷肥厂的主要产品是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙得化学方程式Ca3(PO4)2+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF.
(3)在接触室中设置热交换器的目的是能量循环利用、提高SO2转化率,从而充分利用能源.
(4)热电厂的冷却水是海水,该流程中浓缩盐水除提取盐以外还可提取的物质有镁或溴(写出一种即可).
(5)根据现代化工厂设计理念请提出高炉炼铁厂废气、废渣及多余热能利用的设想:废气(主要是高炉煤气)经除尘后可作为燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料;废渣(主要成分是硅酸钙等),可用作矿渣磷肥的生产原料(写出一点即可)(写出一点即可).
分析 硫铁矿含有FeS2,在沸腾炉中充分反应可生成Fe2O3、SO2,反应放出的热量可用于发电,生成的Fe2O3可用于冶炼铁,二氧化硫可用于生产水泥,二氧化硫可在接触室生成三氧化硫,在吸收塔生成硫酸,加入Ca5(PO4)3F,可生成Ca(H2PO4)2、CaSO4,可用作磷肥,
(1)根据流程图中工业生产的原料,及发生的反应中的能量转化分析;
(2)沸腾炉中FeS2与氧气反应生成氧化铁和二氧化硫;磷矿石和硫酸反应生成Ca(H2PO4)2、CaSO4;
(3)反应是放热反应,热交换器可以利用放出的热量预热参加反应的二氧化硫和氧气,从而实现能量循环利用;
(4)沿海地区有丰富的海水资源;海水中含有丰富的Mg元素、溴元素等
(5)根据工厂的废气、废渣的成分分析.
解答 解:硫铁矿含有FeS2,在沸腾炉中充分反应可生成Fe2O3、SO2,反应放出的热量可用于发电,生成的Fe2O3可用于冶炼铁,二氧化硫可用于生产水泥,二氧化硫可在接触室生成三氧化硫,在吸收塔生成硫酸,加入Ca5(PO4)3F,可生成Ca(H2PO4)2、CaSO4,可用作磷肥,
(1)①中冶炼钢铁的原料是Fe2O3,②中热电厂中向外提供的能量为电能,③沸腾炉中FeS2与氧气反应放出大量的热,④制硫酸时接触室中二氧化硫被氧化,⑤硫酸工业中生成的硫酸,可用于制磷肥,
故答案为:热能;SO2 ;
(2)沸腾炉中FeS2和氧气反应产生二氧化硫和氧化铁,反应的方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;普钙是磷酸二氢钙和硫酸钙,用硫酸与磷酸钙反应生成硫酸钙和磷酸二氢钙的化学方程式为:Ca3(PO4)2+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF,
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;Ca3(PO4)2+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF;
(3)反应2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3是放热反应,热交换器可以利用放出的热量预热参加反应的二氧化硫和氧气,实现了能量的循环利用,
故答案为:能量循环利用;
(4)沿海地区有丰富的海水资源;海水中含有丰富的Mg元素、溴元素等可以制取Mg或溴,
故答案为:海水;镁或溴;
(5)根据工厂的废气、废渣的成分可知,废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料、作矿渣磷肥的生产原料,
故答案为:废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料;废渣(主要成分是硅酸钙等),可用作矿渣磷肥的生产原料.
点评 本题考查化学技术,涉及制工业炼铁、工业制备硫酸、水泥生产、磷肥工业、海水资源的综合利用等知识,根据工艺流程明确实验目的为解答关键,试题培养了学生的分析、理解能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案| A. | 葡萄糖 | B. | 氢氧化钠 | C. | 氯化钾 | D. | 铁 |
| A. | 1L0.1mol•L-1NaClO溶液中,ClO-的数目为0.1NA | |
| B. | 常温常压下,11.2LCH4含有的共用电子对数目为2NA | |
| C. | 16gO2与O3混合气体中,氧原子的数目为1.5NA | |
| D. | 1molFe与足量Cl2完全反应后,转移的电子数目为3NA |
(2)老师在课堂上演示了一个趣味实验:把一块湿润的有色布条放到盛有干燥氯气的集气
瓶中.有色布条很快变成“白色”布条.学生对此进行了猜测.
猜测一:氯气具有漂白性,能使有色布条褪色
猜测二:氯气与湿润有色布条上的水分作用,产生的次氯酸使有色布条褪色.
某同学设计如下实验装置,验证猜想是否正确:
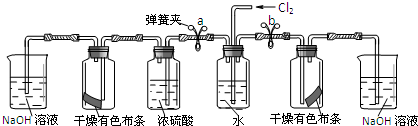
I.将预期的实验现象和结论填在下表中.
| 步骤 | 实验操作 | 预期现象和结论 |
| ① | 松开a处弹簧夹,夹上b处弹簧夹 | 装置左边集气瓶中的有色布条不褪色 删去,证明猜想一不正确. |
| ② | 松开b处弹簧夹,夹上a处弹簧夹 | 装置右边集气瓶中的有色布条褪色, 说明猜想二正确. |
(1)已知一定量的c单质能在O2(g)中燃烧,其可能的产物及能量关系如图1所示:写出co(g)生成co2(g)与C(s)反应的热化学方程式2CO(g)=CO2(g)+C(s)△H=-172.5kJ/mol.
(2)工业用CO制备氢气的一种方法为:C0(g)+H20(g)=molfCO2(g)+H2(g)

①向1L恒容密闭容器中充入CO和H20(g),t℃时测得部分数据如下表.则该温度下反应的平衡常数K=0.5.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) $\stackrel{催化剂}{?}$ 2C02(g)+N2(g)△<0
在密闭容器中发生该反应时,c(C02)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.
①在T2温度下,0〜2s内的平均反应速率v(N2)=0.075mol/(L•s).能使上述平衡体系中$\frac{n(C{O}_{2})}{n(CO)}$ 增大的措施有降低温度或增大压强或增大CO的物质的量或从体系中分离出N2 (任写一条).
②向某密闭恒容容器中按体积比1:1充入44.8L (标准状况)NO和CO混合气体,发生上述反应,下列各项能判断该反应t=10min时反应达到平衡的是BD.(填序号字母)

| A. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| B. | W与X形成的化合物中只含离子键 | |
| C. | X、Y、Z、W的原子半径依次减小 | |
| D. | 若W与Y原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
| A. | 把过量新制的氯水滴加到石蕊试液中,溶液颜色先变蓝后褪色 | |
| B. | 自来水厂用氯气给水消毒,是因为氯气与水反应生成的HClO具有强氧化性 | |
| C. | Cl2、Cl-均有毒 | |
| D. | Cl2、HClO、H2O2都具有漂白性 |