题目内容
20.相同温度,相同物质的量浓度的五种溶液.按pH由大到小的顺序排列,正确的是( )①NH4Cl ②NaHSO4 ③NaCl ④CH3COONa ⑤Na2CO3.
| A. | ⑤>④>①>③>② | B. | ⑤>④>③>①>② | C. | ⑤>④>①>②>③ | D. | ④>⑤>③>①>② |
分析 据溶液的酸碱性以及利用盐类的水解程度比较浓度相同的溶液的pH大小.
解答 解:同温度相同物质的量浓度下列溶液中,NH4Cl中铵根离子水解导致溶液显示酸性,但是酸性小于硫酸氢钠,CH3COONa、Na2CO3是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱水解程度越大,溶液中氢氧根离子浓度越大,pH越大,酸根离子的水解程度大小为CH3COO-<CO32-,所以溶液pH:CH3COONa<Na2CO3,按pH由大到小的顺序排列为:⑤>④>③>①>②.
故选B.
点评 本题考查了溶液pH的大小比较方法应用,主要是离子水解的应用,酸越弱,阴离子水解程度越大.

练习册系列答案
相关题目
10.在硫酸溶液中,NaClO3和Na2SO3能按物质的量之比l:2完全反应,生成一种棕黄色气体X,同时Na2SO3被氧化为Na2SO4,则X为( )
| A. | Cl2 | B. | Cl2O | C. | ClO2 | D. | Cl2O7 |
11.下列说法正确的是( )
| A. | 原子的最外层电子数等于族序数 | |
| B. | 主族元素X、Y能形成XY3型化合物,序数差可能为2、6或8 | |
| C. | 分子结构相似的分子相对分子质量越大熔沸点越高 | |
| D. | 元素的原子得电子越多非金属性越强,失电子越多,金属性越强 |
8.下列各离子浓度的大小比较,正确的是( )
| A. | 同浓度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的顺序是:①>③>② | |
| B. | 常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) | |
| C. | 0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
5.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2CH3COONH4═(CH3COO)2Pb+(NH4)2SO4.当醋酸铅溶液中通入H2S时,有黑色沉淀PbS和弱电解质CH3COOH生成,表示这个反应的有关离子方程式正确的是( )
| A. | Pb2++2CH3COO-+2H++S2-═PbS↓+2CH3COOH | |
| B. | Pb2++H2S═PbS↓+2H+ | |
| C. | Pb2++2CH3COO-+H2S═PbS↓+2CH3COOH | |
| D. | (CH3COO)2Pb+H2S═PbS↓+2CH3COOH |
9.常温下,下列各组离了在指定溶液中一定能大量共存的是( )
| A. | 澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- | |
| B. | 1.Omol•L-1的HNO3溶液:K+、Fe2+、Cl-、SO42- | |
| C. | 1.Omol•L-1 的KI溶液:Na+、Fe3+、Cl-、SO42- | |
| D. | l.Omo•L-1的 CaCl2溶液:Na+、K+、Cl-、CO32- |
10.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)═MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:下列说法正确的是( )
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ(CO)=0.6mol/(L•min) | |
| B. | 4min后,平衡移动的原因可能是向容器中加入了2.0mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0mol,则平衡时n(SO2)=0.6mol |
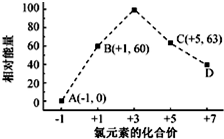 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.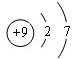 .
.