题目内容
1.下列说法正确的是( )| A. | 将水加热,Kw增大,pH不变 | |
| B. | 燃烧热是指可燃物热化学反应方程式中的△H | |
| C. | 用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 醋酸溶液的导电能力可能比稀硫酸强 |
分析 A.水的电离吸热,升高温度促进电离,导致Kw增大,pH减小;
B.在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热;
C.高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管;
D.溶液的导电能力与离子浓度的大小和所带电荷多少呈正比.
解答 解:A.水的电离吸热,将水加热促进电离,导致Kw增大,pH减小,故A错误;
B.燃烧热为25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,燃烧热都是正值,而反应热中的△H为负值,故B错误;
C.由于高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管,因此量取高锰酸钾溶液应该使用酸式滴定管,故C错误;
D.溶液的导电能力与离子浓度的大小和所带电荷多少呈正比,醋酸溶液中离子浓度远大于硫酸溶液的时,就会出现醋酸溶液的导电能力比稀硫酸强的情况,故D正确;
故选D.
点评 本题考查了影响水的电离的因素、燃烧热、计量仪器的使用方法和溶液导电能力的判断等知识,题目难度中等,注意掌握水的离子积及影响因素、燃烧热的概念、液导电能力的判断依据,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
11.下列说法正确的是( )
| A. | 原子的最外层电子数等于族序数 | |
| B. | 主族元素X、Y能形成XY3型化合物,序数差可能为2、6或8 | |
| C. | 分子结构相似的分子相对分子质量越大熔沸点越高 | |
| D. | 元素的原子得电子越多非金属性越强,失电子越多,金属性越强 |
9.常温下,下列各组离了在指定溶液中一定能大量共存的是( )
| A. | 澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- | |
| B. | 1.Omol•L-1的HNO3溶液:K+、Fe2+、Cl-、SO42- | |
| C. | 1.Omol•L-1 的KI溶液:Na+、Fe3+、Cl-、SO42- | |
| D. | l.Omo•L-1的 CaCl2溶液:Na+、K+、Cl-、CO32- |
10.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)═MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:下列说法正确的是( )
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ(CO)=0.6mol/(L•min) | |
| B. | 4min后,平衡移动的原因可能是向容器中加入了2.0mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0mol,则平衡时n(SO2)=0.6mol |
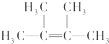 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯.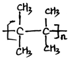 .
.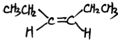 或(CH3CH2)2C=CH2.
或(CH3CH2)2C=CH2.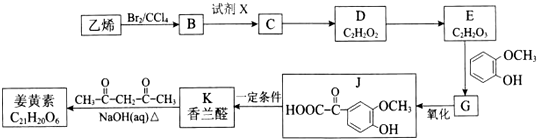
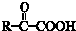 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$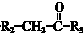
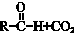 $→_{△}^{NaOH(ap)}$R1-
$→_{△}^{NaOH(ap)}$R1-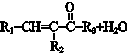
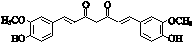 .
.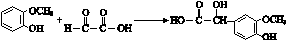 ;其反应类型是加成反应.
;其反应类型是加成反应.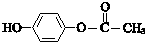 .
.