题目内容
10.某小组同学以石墨为电极电解CuCl2溶液时,发现阴极石墨电极上除了有红色物质析出外,还有少量白色物质析出.为探究阴极石墨电极上的产物,同学们阅读资料并设计了如下过程:Ⅰ.查阅资料:铜的化合物颜色性质如下
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证 取电解CuCl2溶液后的阴极石墨电极,洗涤、干燥,连接下列装置进行实验,验证阴极产物
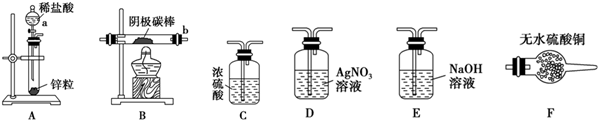
①实验前,检查装置A气密性的方法是将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗的活塞,水的液面不会连续下降,证明装置A的气密性好.
②实验时,各装置从左至右的连接顺序为A→E→C→B→F→D.(填装置代号)
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象
①碳棒上的红色物质是否有Cu2O否(填“是”或“否”),理由是F中物质不变蓝色;
②装置D(填上图中装置编号)中出现白色沉淀的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(4)问题讨论
①电解CuCl2溶液阴极上除发生Cu2++2e-═Cu的反应外,还发生的反应为2Cu2++2e-+2Cl-=2CuCl;
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是氢气和氧气混合加热可能发生爆炸和空气中水蒸气会干扰Cu2O是否存在的判断.
分析 (1)由Cu的化合物的颜色可知,CuCl为白色固体;
(2)①利用装置不漏气检验装置的气密性;
②阴极产物为Cu,可能有Cu2O、CuCl,与干燥纯碱氢气反应后,通无水硫酸铜若不变色说明阴极碳棒上的产物与氢气反应产物中没有水,再检验氯离子;
(3)无水硫酸铜不变色说明阴极碳棒上的产物与氢气反应产物中没有水;分解实验现象分析理由;
根据CuCl与氢气反应生成了氯化氢,通过检验氯离子判断是否存在CuCl;
③装置b中发生反应的化学方程式为氯化亚铁与氢气反应生成铜和氯化氢;
(4)①电极氯化铜溶液阴极铜失去电子生成铜离子和氯化亚铜,据此写成电极反应的离子方程式;
②氢气不纯可能发生爆炸,水蒸气中含氧元素干扰实验.
解答 解:(1)由Cu的化合物的颜色可知,CuCl为白色固体,故答案为:CuCl;
(2)①利用装置不漏气检验装置的气密性,其方法为将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗的活塞,水的液面不会连续下降,证明装置A的气密性好,
故答案为:将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗的活塞,水的液面不会连续下降,证明装置A的气密性好;
②阴极产物为Cu,可能有Cu2O、CuCl,生成氢气经过E除去HCl,经过C干燥,然后通入B中反应后,通过F检验是否存在Cu2O,再利用D检验氯离子,正确的顺序为A→E→C→B→F→D,
故答案为:E;C;F;D;
(3)①由于无水硫酸铜不变色,证明中b反应产物没有水生成,碳棒上的红色物质中没有氧元素,一定不会含有氧化亚铜,
故答案为:否;F中物质不变蓝色;
②假设②中,白色物质若为CuCl,CuCl与氢气反应会生成氯化氢,将生成产物通入硝酸银溶液中,若D中生成了白色沉淀,证明白色物质为CuCl,
故答案为:D,出现白色沉淀;
③装置b中发生反应为CuCl与氢气反应,反应的化学方程式为:2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl,
故答案为:2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl;
(4)①电解CuCl2溶液时,阴极上发生的反应为Cu2++2e-=Cu,且生成氯化亚铜发生2Cu2++2e-+2Cl-=2CuCl,
故答案为:2Cu2++2e-+2Cl-=2CuCl;
②用若装置b中的空气没有排净就开始加热,氢气和氧气混合加热可能爆炸,且空气中水蒸气会干扰Cu2O是否存在的判断,
故答案为:氢气和氧气混合加热可能发生爆炸,空气中水蒸气会干扰Cu2O是否存在的判断.
点评 本题考查物质的检验与鉴别,题目难度中等,该题是高考中的常见题型,试题综合性强,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.该类试题需要注意的是进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象.

| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Y位于元素周期表第三周期第VI族.
(3)元素Z的原子最外层共有17种不同运动状态的电子.
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.W的基态原子核外价电子排布图是
 .
.(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性强弱为HClO4>H2SO4(用化学式表示).比较下列物质的酸性强弱:HZO<HZO3<HZO4.
(7)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的常见分子的分子式为CO.
| A. | V=4.48 L | B. | V=5.6 L | C. | 4.48 L<V<5.6 L | D. | V<4.48 L |
| A. | 摩尔是描述微观粒子多少的物理量 | |
| B. | 物质的量将可称量的宏观物质与一定数目微观粒子联系起来 | |
| C. | 1molO2的质量为32g•mol-1 | |
| D. | 22.4L H2的物质的量为1mol |
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4-在反应中失去5mol电子 | ||
| C. | 从反应中看出草酸性质很不稳定 | D. | 配平该反应后,H+的计量数是6 |
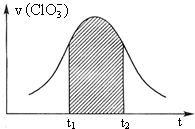 KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )
KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )| A. | 开始时反应速率增大可能是由c(H+)增大所致 | |
| B. | 纵座标为v(H+)的v-t曲线与右图曲线完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 阴影部分面积可以表示t1-t2时间内c(Cl-)增加 |
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 结晶 |
 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.