题目内容
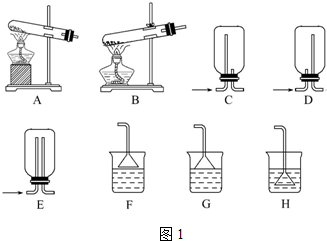
20.如果家里的食用菜籽油混有少量水份,你将采用下列何种方法分离( )| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 结晶 |
分析 食用菜籽油和水互不相溶,可用分液的方法分离,以此解答.
解答 解:A.过滤可以把不溶于液体的固体物质和液体分离,食用菜籽油和水是互不相溶的液体,不能用过滤的方法,故A错误;
B.蒸馏通常用于分离提纯沸点差别较大的互溶的混合化合物,食用菜籽油和水沸点相差较小,且不互溶,故B错误;
C.食用菜籽油和水两种物质互不相溶,分层,可用分液的方法进行分离,下层液体水先从分液漏斗中流出,上层液体食用菜籽油从上口倒出,故C正确;
D.结晶是利用混合物中各成分在同一种溶剂里溶解度的不同或在冷热情况下溶解度显著差异,而采用结晶方法加以分离的操作方法,故D错误;
故选C.
点评 本题考查混合物的分离、提纯,侧重除杂和分离的考查,把握物质的化学性质为解答本题的关键,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
10.某小组同学以石墨为电极电解CuCl2溶液时,发现阴极石墨电极上除了有红色物质析出外,还有少量白色物质析出.为探究阴极石墨电极上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.查阅资料:铜的化合物颜色性质如下
Ⅱ.实验探究:
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证 取电解CuCl2溶液后的阴极石墨电极,洗涤、干燥,连接下列装置进行实验,验证阴极产物
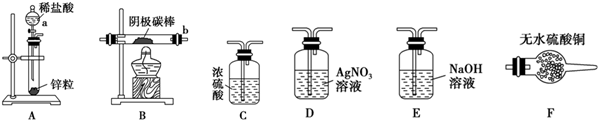
①实验前,检查装置A气密性的方法是将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗的活塞,水的液面不会连续下降,证明装置A的气密性好.
②实验时,各装置从左至右的连接顺序为A→E→C→B→F→D.(填装置代号)
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象
①碳棒上的红色物质是否有Cu2O否(填“是”或“否”),理由是F中物质不变蓝色;
②装置D(填上图中装置编号)中出现白色沉淀的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(4)问题讨论
①电解CuCl2溶液阴极上除发生Cu2++2e-═Cu的反应外,还发生的反应为2Cu2++2e-+2Cl-=2CuCl;
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是氢气和氧气混合加热可能发生爆炸和空气中水蒸气会干扰Cu2O是否存在的判断.
Ⅰ.查阅资料:铜的化合物颜色性质如下
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
(1)提出假设:①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为CuCl.
(2)实验验证 取电解CuCl2溶液后的阴极石墨电极,洗涤、干燥,连接下列装置进行实验,验证阴极产物

①实验前,检查装置A气密性的方法是将橡胶管套在导气管上,用弹簧夹夹紧橡胶管,向分液漏斗中注入水,打开分液漏斗的活塞,水的液面不会连续下降,证明装置A的气密性好.
②实验时,各装置从左至右的连接顺序为A→E→C→B→F→D.(填装置代号)
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象
①碳棒上的红色物质是否有Cu2O否(填“是”或“否”),理由是F中物质不变蓝色;
②装置D(填上图中装置编号)中出现白色沉淀的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
(4)问题讨论
①电解CuCl2溶液阴极上除发生Cu2++2e-═Cu的反应外,还发生的反应为2Cu2++2e-+2Cl-=2CuCl;
②实验过程中,若装置B中的空气没有排净就开始加热,可能对实验造成的影响是氢气和氧气混合加热可能发生爆炸和空气中水蒸气会干扰Cu2O是否存在的判断.
8.重水(D2O)是重要的核工业原料,下列说法错误的是( )
| A. | H2O与D2O互称同位素 | B. | 氘(D)原子核外有1个电子 | ||
| C. | H与 D中子数不同 | D. | H218O与D216O的相对分子质量相同 |
15.如图装置应用于实验室制氯气和有关氯气性质的实验,能达到实验目的是( )

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 装置丙:生成棕色的固体,证明Cl2有强氧化性 | |
| D. | 装置丁:湿润的有色布条褪色,证明Cl2有漂白性 |
5.下列变化需要加入还原剂的是( )
| A. | N2O5→HNO3 | B. | Cl-→ClO3- | C. | MnO2→Mn2+ | D. | H2→H2O |
9.下列说法正确的是( )
| A. | 对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加 | |
| B. | 设NA为阿伏加德罗常数的值,500 mL 1mol/L氯化铁溶液中Fe3+的数目等于0.5NA | |
| C. | 常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12 | |
| D. | 要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应 |