题目内容
10.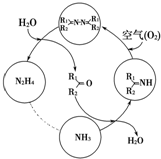 利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).
利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).①在图示的转化中,化合价不变的一种元素是氢或H.
②反应中当有1mol NH3转化为N2H4时,保持溶液中酮的物质的量不变,需要消耗O2的物质的量为0.25mol.
③在温度一定和不补加溶液的条件下,缓慢通入NH3、O2混合气体,并充分搅拌.欲使生成的N2H4中不含NH3,可采取的措施有增大混合气体中氧气的含量.
分析 ①由图示可知化合价不变的一种元素是+1价的氢;
②反应中当有1mol NH3转化为N2H4时,失去1mol的电子,而1mol氧气得到4mol的电子,根据得失电子守恒分析解答;
③可以通过增加通入氧气的量,来提高氨气的转化率,由此分析解答.
解答 解:①由图示可知化合价不变的一种元素是+1价的氢,故答案为:氢或H;
②反应中当有1mol NH3转化为N2H4时,失去1mol的电子,而1mol氧气得到4mol的电子,根据得失电子守恒可知消耗氧气的物质的量为=$\frac{1}{4}mol$=0.25 mol,
故答案为:0.25 mol;
③欲使生成的N2H4中不含NH3,可采取的措施增大混合气体中氧气的含量,使氨气完全转化,故答案为:增大混合气体中氧气的含量.
点评 本题考查氧化还原反应的知识,应用得失电子守恒和平衡的移动原理,和得失电子守恒的相关知识,比较容易.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
1.硫酸亚铁晶体( FeSO4•7H2O)俗称绿矾,加热至高温会发生分解,为确定绿矾分解产生的非金属氧化物,进行如下探究.
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3:非金属氧化物SO2、SO3.
(2)现设计如图所示实验装置(图中铁架台略去),检验绿矾的分解产物.
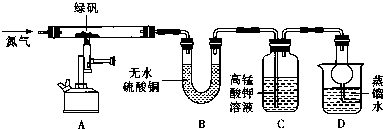
按上述装置进行实验,同学们观察到如下现象:
(3)结合实验现象,理论上分析可知绿矾分解还生成另一物质SO3.其理论依据是每两个FeSO4分解生成1个Fe2O3后剩余S、O原子个数比为2:5不等于1:2,若只生成Fe2O3和SO2,S和O之比为1:3.5,元素不守恒,故可通过理论分析得出:绿矾分解还生成另一物质SO3.
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左一右),注明药品的名称[可供选择的药品有1mol/L NaOH溶液、0.5mol/L BaCl2溶液、0.5mol/L Ba(NO3)2溶液].
装置示意图现象结论 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
(5)根据上述实验,写出绿矾高温分解的化学方程式2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O.
(1)假设1:非金属氧化物为SO2;
假设2:非金属氧化物为SO3;
假设3:非金属氧化物SO2、SO3.
(2)现设计如图所示实验装置(图中铁架台略去),检验绿矾的分解产物.

按上述装置进行实验,同学们观察到如下现象:
| 装置 | 现象 | 结论 |
| A | 固体呈红棕色,将其放入足量稀盐酸,固体全部溶解,得到黄色溶液 | |
| B | 无水硫酸铜变蓝 | |
| C | 高锰酸钾溶液褪色 |
(4)为证明反应产生了SO3,应在B、C之间补充一个装置,请你在下表中画出实验装置图(气流方向:左一右),注明药品的名称[可供选择的药品有1mol/L NaOH溶液、0.5mol/L BaCl2溶液、0.5mol/L Ba(NO3)2溶液].
装置示意图现象结论
 瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3
瓶内为0.5mol/L的BaC12溶液,有白色沉淀生成说明分解产物SO3(5)根据上述实验,写出绿矾高温分解的化学方程式2FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O.
18.将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量不变的是( )
| A. | H2SO4 | B. | C2H5OH | C. | HNO3 | D. | NaOH |
5.下列物质转化在给定条件下能实现的是( )
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | NH3$\stackrel{O_{2}/催化剂}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
15.某校兴趣小组对SO2与新制Cu(OH)2悬浊液的反应进行探究,实验如表:
(1)制取新制Cu(OH)2悬浊液的离子方程式为Cu2++2OH-═Cu(OH)2↓.
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净.向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:黄色沉淀消失,生成大量白色沉淀(或实验II与实验I的现象差异)与Cl-有关(或与SO42-无关).
检验Cu(OH)2洗涤干净的方法是取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净.
(3)同学们对白色沉淀的成分继续进行探究.查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸.它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液.
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl+2NH3•H2O═Cu(NH3)2++Cl-+2H2O、4Cu(NH3)2++8NH3•H2O+O2═4Cu(NH3)42++4OH-+6H2O.
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如图:
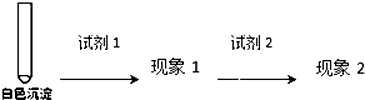
填写如表空格:
③写出实验II中由Cu(OH)2生成白色沉淀的离子方程式:2Cu(OH)2+2Cl-+SO2═2CuCl↓+SO42-+2H2O.
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O.完成合理的实验方案:取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同),则说明砖红色沉淀是Cu2O.
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入 | 实验Ⅰ | 1.5mL 1mol•L-1 CuSO4溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL 1mol•L-1 CuCl2溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净.向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:黄色沉淀消失,生成大量白色沉淀(或实验II与实验I的现象差异)与Cl-有关(或与SO42-无关).
检验Cu(OH)2洗涤干净的方法是取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净.
(3)同学们对白色沉淀的成分继续进行探究.查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸.它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液.
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl+2NH3•H2O═Cu(NH3)2++Cl-+2H2O、4Cu(NH3)2++8NH3•H2O+O2═4Cu(NH3)42++4OH-+6H2O.
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如图:

填写如表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O.完成合理的实验方案:取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同),则说明砖红色沉淀是Cu2O.
2.下列化学反应的离子方程式正确的是( )
| A. | Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将过量SO2气体通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| C. | 用醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
19.下列离子方程式书写正确的是( )
| A. | 铜片与浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O | |
| B. | 向漂白精溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| C. | H2C2O4溶液能使KMnO4酸性溶液褪色 2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| D. | 向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |